
13.下列有关说法不正确的是
A.石墨晶体是层状结构,在每一层内,每一个碳原于都跟其他3个碳原子相结合,图1是其晶体结构的俯视图
B.CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C.H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D.比较Na2CO3、NaHCO3的热稳定性可用如图4所示装置,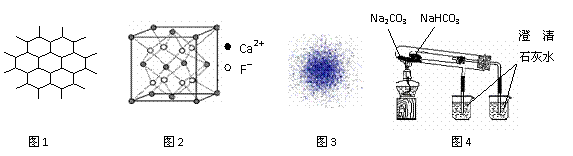
12.金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2 + bCl2 + cC 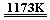 aTiCl4 + cCO ……反应①TiCl4 +2Mg
aTiCl4 + cCO ……反应①TiCl4 +2Mg 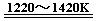 Ti + 2MgCl2
……反应②
Ti + 2MgCl2
……反应②
关于反应①、②的分析不正确的是
(1) TiCl4在反应①中是还原产物,在反应②中是氧化剂;(2) C、Mg在反应中均为还原剂,被还原;(3)在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4;(4) a=1,b=c=2;(5) 每生成19.6 g Ti,反应①、②中共转移4.8 mol e-。
A.(1)(2)(4) B.(2)(3)(4) C.(3)(4) D.(2)(5)
11.在含有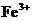 、
、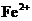 、
、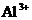 、
、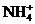 的溶液中,加入足量的
的溶液中,加入足量的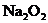 固体并加热,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是
固体并加热,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是
A.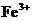 B.
B.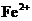 C.
C.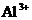 D.
D.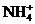
10.X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.X与W可以形成W2X、W2X2两种化合物
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为W<X<Y<Z
D.Y、Z两元素的简单离子的半径Y>Z
9.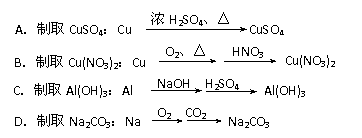 下列实验室制取物质的思路既合理又符合绿色化学思想的是
下列实验室制取物质的思路既合理又符合绿色化学思想的是
8.下列说法正确的是
A.原子晶体中只存在非极性共价键 B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
7.下列有关化学键与晶体结构说法正确的是
A 两种元素组成的分子中一定只有极性键
B 离子化合物的熔点一定比共价化合物的高
C 非金属元素组成的化合物一定是共价化合物
D 含有阴离子的化合物一定含有阳离子
6.下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
5.正确掌握化学用语和化学基本概念是学好化学的基础。下列表述中正确的是
A.物质熔沸点的高低顺序是:氯化钠>晶体硅>冰>氖气
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.P4、CH4、NH4+粒子的空间构型均为正四面体型;CO2、C2H2均为直线型分子
D.Ca2+的结构示意图为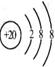 ,NH4Cl的电子式为
,NH4Cl的电子式为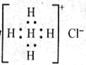
4.请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是
A 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C 一定条件下,金属钠可以成为绝缘体
D 一定条件下,水在20℃时能凝固成固体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com