
0.1000mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00 mL,计算结果。
请回答下列问题:
⑴步骤 1中,使茶叶灰化需要三角架、泥三角、酒精喷灯、 、 等仪器。
⑵步骤2中,判断沉淀已经洗涤干净的方法是 。
⑶步骤3中,滴定操作时,眼睛注视 。被滴定的20 mL滤液中 CO32-的物质的量为__ _mol,原茶叶中钙离子的质量分数为___ _ __。
30.茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500克干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6-7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30 min,加入7.95 g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用
29.Fe2O3和Cu2O 都是砖红色粉末,课外小组通过实验探究某砖红色粉末是Fe2O3、Cu2O或者是二者混和物。探究过程如下:
查阅资料:Cu2O是碱性氧化物,Cu2O与H+反应生成的Cu+不稳定,立即转化成Cu2+和Cu。
提出假设:假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末为Fe2O3、Cu2O的混和物
设计探究实验
取少量粉末,向其加入足量稀HCl在所得溶液中滴加苯酚溶液
(1) 若假设1成立,则实验现象是
(2) 若滴加苯酚后溶液不变紫色,则证明原固体粉末不含Fe2O3。你认为结论是否合理 (填合理或不合理)简述理由
(3)若固体粉末完全溶解无固体存在,滴加苯酚时溶液不变紫色,证明原固体粉末是
相关的离子方程式为
28. 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)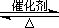 2SO3(g)
2SO3(g)
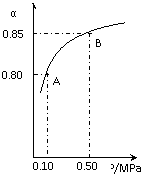
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
27.物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
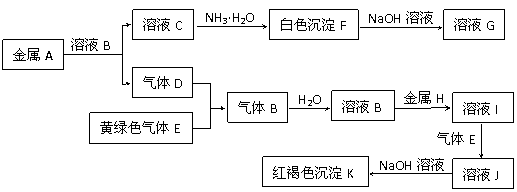

(1) 写出下列物质的名称:A是 ,B是 ,
D是 ,K是 ;
(2) 写出反应“C→F”的离子方程式: ;
(3)写出反应“F→G”的化学方程式: ;
(4) 写出反应“I→J”的化学方程式: 。
26.

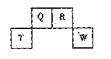 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
 (1)T的原子结构示意图为 。
(1)T的原子结构示意图为 。
 (2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”)。
 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
 (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 。
 (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的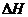 =
(注:题中所设单质均为最稳定单质)。
=
(注:题中所设单质均为最稳定单质)。
25、意大利科学家使用普通氧分子和带正电荷的氧离子作用,制出了新型的氧分子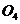 ,它具有很强的氧化性;它的结构很复杂,可能具有与
,它具有很强的氧化性;它的结构很复杂,可能具有与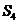 相似的长方形结构。
相似的长方形结构。
(1)下列有关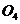 的说法正确的是:
的说法正确的是:
A.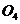 分子内存在极性共价键
分子内存在极性共价键
B.合成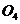 的反应可看作核聚变反应,即不属于化学变化
的反应可看作核聚变反应,即不属于化学变化
C.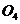 与
与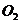 、
、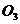 都互为同素异形体
都互为同素异形体
D.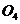 将来可用作更强有力的火箭推进的氧化剂
将来可用作更强有力的火箭推进的氧化剂
(2)制备含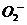 、
、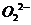 甚至
甚至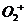 的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:
的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:
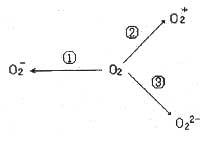
上述三个反应中, (填序号)相当于氧分子被氧化; (填序号)相当于氧分子被还原。
(3)写出 的电子式:
的电子式:
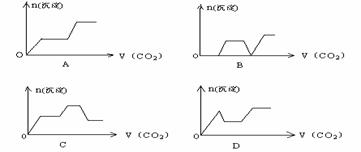
24.将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为:
23.常见的晶体有如下类型:①分子晶体 ②离子晶体 ③原子晶体④金属晶体,在非金属元素所形成的单质或化合物中,固态时的晶体类型可以是( )
A、①②③④ B、只有①③④ C、只有①②③ D、只有①③
21.1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+a
Y(g)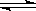 b Z(g) 反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是:
b Z(g) 反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是:
A、a=1,b=1 B、a=2,b=1 C、a=2,b=2 D、a=3,b=4
22 .2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球 “最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是
.2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球 “最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.ETFE膜(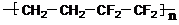 )是由两种单体缩聚而成的
)是由两种单体缩聚而成的
D.用金属铝与V2O5冶炼钒,铝作还原剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com