
23.(07重庆卷) a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2:3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是__________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)__________________;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为__________________,Z的晶体类型为_____________;ab-离子的电子式为____________。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)_____________________________________。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为__________________、___________________。
22.(08四川卷)D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)Y的最高价氧化物的化学式为______________。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是____________,写出该元素的任意3种含氧酸的化学式:_______________________。
(3)D和形成的化合物,其分子的空间构型为________________。
(4)D和X形成的化合物,其化学键类型属_______________,其晶体类型属_____________________。
(5)金属镁和E的单质在高温下反应得到的产物是__________,此产物与水反应生成两种碱,该反应的化学方程式是___________________________。
(6)试比较D和X的最高价氧化物熔点的高低并说明理由_______________________________________。
21.(05江苏卷)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能 / kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
 请回答下列问题:
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si;SiCl4 SiO2
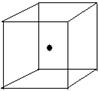
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
 (3)工业上高纯硅可通过下列反应制取:
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g) Si(s)+4HCl(g)
该反应的反应热△H=_____________kJ / mol
考点3 综合应用
20. (06江苏卷)下列关于晶体的说法一定正确的是( )
(06江苏卷)下列关于晶体的说法一定正确的是( )
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
19.(07海南卷)NaCl的晶胞如图,每个NaCl晶胞中含有的Na+离子和Cl-离子的数目分别是( )


A.14,13 B. 1,1 C. 4,4 D. 6,6
18.(08海南卷)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的:
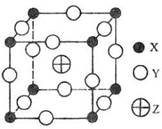
A.ZXY3 B.ZX2Y6 C.ZX4Y8 D.ZX8Y12
17.(04北京卷)近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80Mpa下合成出金刚石,具有深远意义。下列说法不正确的是( )
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
考点2 计算晶体的化学式
16.(04广东卷)X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是( )
A.WX4是沼气的主要成分 B.固态X2Y是分子晶体
C.ZW是原子晶体 D.ZY2的水溶液俗称“水玻璃”
15.(04上海卷)有关晶体的下列说法中正确的是( )
A.晶体中分子间作用力越大,分子越稳定 B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂 D.氯化钠熔化时离子键未被破坏
14.(05上海卷)下列说法错误的是( )
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服分子间作用力
C.金属晶体通常具有导电、导热和良好的延展性
D.离子晶体在熔化状态下能导电
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com