
14.(10分)能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
 (1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);△H
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);△H
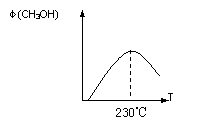
右图表示某次合成实验过程中甲醇的体积分数
φ(CH3OH)与反应温度的关系曲线,
则该反应的△H 0(填“>、< 或 = ”)
(2)若在230℃时,平衡常数K=1。若其它条件不
变,将温度升高到500℃时,达到平衡时,K 1
(填“>、< 或 = ”)
 (3)在某温度下,向一个容积不变的密闭容器中通
(3)在某温度下,向一个容积不变的密闭容器中通
入2.5mol CO和7.5mol H2,达到平衡时CO的转化
率为90%,此时容器内的压强为开始时的 倍。
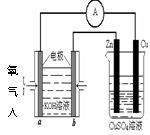
(4)利用甲醇燃料电池设计如右图所示的装置:
则该装置中Cu极为 极;
写出b极的电极反应式
当铜片的质量变化为12.8 g时:a极上消耗的O2在
标准状况下的体积为 L。
13.(8分)下图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一。 A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质。
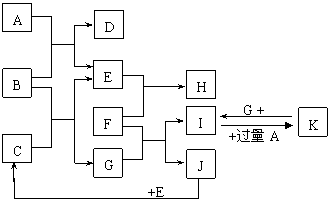
试回答下列问题:
(1) 写出B的化学式: ,写出A的电子式 ;
(2)写出I→K的离子方程式 ;
(3)写出F与Fe3O4在高温下反应的化学方程式 ;
(4)已知3g J完全燃烧放出a kJ的热量,请写出表示J的燃烧热的热化学方程式:
。
12.已知2Fe2+ +Br2=2Fe3++2Br-。向10mL0.1mol·L-1 的FeBr2溶液中通入0.001mol Cl2,反应后的溶液中,除含有Cl-外还一定 ( )
A.含Fe2+,不含Fe3+ B.含Fe3+,不含Br-
C.含Fe3+,含有Br- D.含Fe2+,含有Fe3+
第Ⅱ卷(共64分)
11.关于浓度均为0.1 mol/L的三种溶液:①CH3COOH、②NaOH、③CH3COONa溶液,下列说法不正确的是 ( )
A.c(CH3COO-):③>①
B.水电离出的c(OH-):②>①
C.①和②等体积混合后的溶液: c(OH )=c(H+)+ c(CH3COOH)
)=c(H+)+ c(CH3COOH)
D.①和③等体积混合后的溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
10.以下物质间的转化通过一步反应不能实现的是 ( )
A.HCl →Cl2→HClO→NaClO
B.Na→Na2O2→Na2CO3→NaHCO3
C.Si→SiO2→H2SiO3→Na2SiO3
D.Al→NaAlO2 →Al(OH)3→Al2O3
9.右表是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21。下列说法正确的是 ( )
|
|
X |
|
Y |
|
Z |
|
W |
|
A.X元素可形成六种氧化物
B.Y元素的最高价氧化物的水化物是含氧酸中酸性最强的
C.X元素的非金属性比Y元素非金属性强
D.Z和X能以共价键结合形成一种无机非金属材料
8.在下列各溶液中,离子可能大量共存的是 ( )
A.透明的溶液中:Cu2+、Fe3+、NO3-、、Cl-
B.使pH试纸变红的溶液中:NH4+、Na+、SO42-、Cl-
C.含有大量ClO-的溶液中:K+、H+、I-、SO32-
D.水电离产生的c(H+) =10-12mol·L-1的溶液中:Na+、Fe2+、SO42-、NO3-
7.用NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A.100mL 1mol/L FeCl3溶液中含阳离子数为0.1NA
B.78 g Na2O2中所含阴离子数为1NA
C.常温常压下,22.4LCH4气体与足量Cl2反应可生成NA个CH3Cl分子
D.80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA
6.《青花瓷》中所描绘的“屏层鸟绘的牡丹一如你梳妆” 、“色白花青的景已跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来才知道大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是( )
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.易溶解于强酸和强碱溶液
D.x等于6
5.只用水不能鉴别的一组物质是 ( )
A.乙醇和乙酸 B.乙酸乙酯和乙醇
C.苯和四氯化碳 D.苯和溴苯
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com