
1. (2009江苏卷13)该法第三十八条规定:“食品、食品添加剂和食品相关产品的生产者,应当依照食品安全标准对所生产的食品、食品添加剂和食品相关产品进行检验,检验合格后方可出厂或者销售。”这一规定要求食品生产者必须
A.严格遵守市场规则
B.转变企业经营方式
C.明确企业经营战略
D.提高自主创新能力
[答案解析]A 本题考查市场秩序与市场规则的知识,考查学生理解和运用知识的能力。
食品生产者要依照食品安全标准进行生产、检验,这实际是要求食品生产者严格遵守市场规则,BCD各项均不符合题意。故A项正确。
2、国际经济竞争与合作
(1)国际经济组织:三大经济组织,重点是WTO,与选修三相结合。
(2)重点:对外开放与国际经济合作:
①原因:是经济全球化的必然要求;是发展社会主义市场经济的必然要求;是进行社会主义现代化建设的必要条件。②全面提高对外开放水平的措施:③“引进来”与“走出去”相结合的战略:“引进来”的必要性及新形势下如何引进;“走出去”含义、主要内容及主要措施。④结合当前国内、国际经济形势,分析如何扩大出口,拉动内需,提高对外开放水平,增强我国国际竞争力。
[真题研析]
1、重点:经济全球化
把握:①含义及其表现:生产全球化、贸易全球化、资本全球化。②影响:是一把双刃剑。透过其实质,分析其消极影响;还应看到其积极影响。③如何应对:抓住机遇,积极参与,趋利避害,勇敢地迎接挑战。④根据美国次贷危机引发的全球金融危机,分析经济全球化的影响,特别是多我国的影响,即如何积极应对,保护我国经济安全。
2、必考点:促进国家的经济发展:
(1)科学发展观。①原因:片面追求GDP带来的一系列问题;②含义:③内容:第一要义是发展,核心是以人为本,基本要求是全面可持续,根本方法是统筹兼顾,主旨在于更好的发展。注意对“统筹兼顾”的内容根据十七大的表述完善。
(2)经济持续协调发展。①原因:②措施:提高自主创新能力,建设创新型国家;加快转变经济发展方式,推动产业结构优化升级;统筹城乡发展,推进社会主义新农村建设;加快能源资源节约和生态环境保护,增强可持续发展能力;推进区域协调发展,缩小区域发展差距。
(3)结合全党深入学习实践科学发展观活动的要求、神七飞天、中央农村工作会议精神,分析落实科学发展观,提高自主创新能力,建设新农村等问题。
1、小康社会:①表现:从微观和宏观两个方面;②特点:低水平的、不全面的、发展不平衡的小康。③目标:注意结合党的十七大的新表述理解。
2、社会主义市场经济
(1)基本特征:基本标志、根本目标和强有力的宏观调控。用共性与个性的关系,分析其与资本主义市场经济的异同。
(2)必考点:我国的宏观调控
①原因:弥补市场调节的不足;由我国的社会主义性质决定的;是社会主义公有制及共同富裕的目标要求的。②主要目标:③手段:经济手段、法律手段和必要的行政手段;从其含义和常用的具体措施来加以区分。④易错点:市场在资源配置中起基础性作用,而不是国家宏观调控。
(3)运用这一部分理论知识,分析重大经济事件、国家财政政策和货币政策的调整、中央经济工作会议精神等;结合改革开放30年的伟大成就、奥运会和神舟七号飞船的成功,分析社会主义制度的优越性。
1、市场经济基本原理
(1)市场:①市场是合理配置资源的基本手段之一;②市场配置资源的优点;③市场如何实现对资源的优化配置。
(2)重点:区分市场调节的弊端:
|
|
原因 |
结果 |
侧重点 |
|
自发性 |
价值规律发挥作用与人们追求自身经济利益的行为是自发的、不需人为引导 |
出现不利于经济和社会健康发展的现象 |
自发追求经济利益而不择手段 |
|
盲目性 |
商品生产者和经营者不可能完全掌握市场各方面的信息,也无法控制经济变化的形势 |
造成经济被动和资源浪费 |
对生产某种商品以及生产数量“一窝蜂” |
|
滞后性 |
市场调节是一种事后调节,从价格形成、价格信号传递到商品生产的调整有一定的时间差 |
导致经济波动和资源浪费,尤其是在建设周期长的项目上 |
生产经营决策落后于经济形势的变化 |
(3)市场秩序:①市场秩序的重要性:市场经济是法制经济,也是信用经济、道德经济;②市场规则的内容;③社会信用制度的必要性和措施。④应结合重大食品安全事件分析其必要性。
17.(8分)茉莉花香气的成分有多种,乙酸苯甲酯( )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
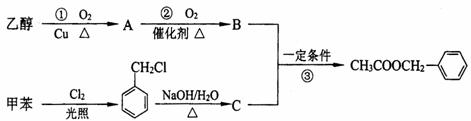
(1)写出反应①的化学方程式:
(2)反应③的反应类型为
(3)C的结构简式为
(4)上述①②③三个反应中,原子的理论利用率为100%,符合绿色化学的要求的反应是 (填序号)。
选考题(第18-1、18-2题为《有机化学基础》模块题,第19-1、19-2题为《物质结构与性质》模块题,第20-1、20-2题为《化学与技术》模块题,每个模块满分均为20分。考生只能从三个模块中任选一个作答,不得跨模块答题,否则只能以所答的第一个模块计分。答题前,请用2 B铅笔在答题卡上把所选模块对应的标号涂黑。注意所做模块题必须与所涂模块相同。)
《有机化学基础》
18-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)
下列关于有机物的说法中,正确的是 ( )
A.蔗糖是高分子化合物,其水解产物能发生银镜反应
B.橡胶和纤维不一定都是合成高分子材料
C.常温下淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应
D.将某烃类的混合气体跟Cl2混合光照,发现有油状液滴生成,说明混合气体肯定含有甲烷

E. 分子中所有原子不可能共平面
18-2.(14分) 已知:一个碳原子上连有两个羟基时,易发生下列转化:

请根据下图作答:
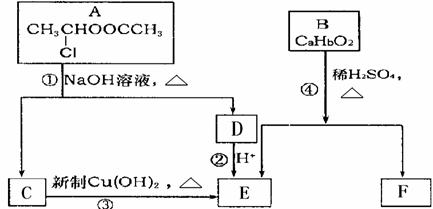
(1) A的核磁共振氢谱中出现 组峰;E中含有的官能团的名称是
(2)反应③的化学方程式为
(3)已知B的相对分子质量为162,其完全燃烧的产物中CO 2和H2O的物质的量之比为 n(CO2) ︰n (H2O)=2︰1,则B的分子式为
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:①属于芳香族化合物;②能跟FeCl3溶液发生显色反应;③能发生加聚反应;④苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有多种可能的结构,请写出它们的结构简式
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
A.基态原子中不一定都有未成对的电子
B.由极性键形成的分子一定是极性分子
C.晶格能大小顺序:NaCl > KCl
D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子
E.在CaO和SiO2晶体中,都不存在单个小分子
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的基态电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
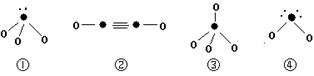
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
《化学与技术》
20-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列有关工业生产的叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可以提高N2、H2转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
E.炼铁过程中碳被氧化,既起产生热量的作用,又起产生CO的作用
20-2.(14分)海南省是海洋大省,海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:

(1)请列举海水淡化的两种方法 、 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是: 。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以
用做镁蒸气的冷却剂的是 ( )
A.H2 B.CO2
C.空气 D.O2 E.水蒸气
(5)从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来
看,你认为该化工厂还可以再增加的生产项目的 。
16.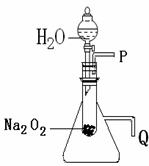 (9分)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(9分)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所推出的结论是:第一:有氧气生成;第二: 。
Na2O2跟水反应的化学方程式是 。
(2)某研究性学习小组拟用右图所示装置(气密性良好)进行实验,以证明上述结论。
①用以验证第一条结论的实验操作及现象是:
②用以验证第二条结论的实验操作及现象是:
(3)实验(2)向试管中加水至固体完全溶解且不再有气泡生成后,滴入酚酞试液,发现溶液先变红后褪色,为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请从另外一个角度(即不能再使用酸碱指示剂)设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。
。

15.(9分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
(1)氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用。
①下图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母a、b的代数式表示)

②氨气溶于水得到氨水。在25°C下,将m mol·L-1的氨水与n mol·L-1的盐酸等体积混合,反应后的溶液呈中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含m和n的代数式表示出混合液中氨水的电离平衡常数表达式 。
(2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。
25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入适量0.1mol·L-1的NaI溶液,振荡、静置,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com