
3.不足:不能科学的解释 的本质,不能解释自然选择如何对可遗传的变异起作用。
2.意义:能科学的解释 的原因,以及生物的 性和 性。
1.主要内容:
(1)过度繁殖:生物的繁殖能力很强,能产生大量后代。(基础)
(2)生存斗争:部分个体被淘汰。(动力)
(3)遗传变异:生物个体既有亲本的遗传性状,又会出现变异。(内因)
(4)适者生存:在生存斗争中,有利变异的个体适者生存,不利变异的不适者淘汰。(结果)
21、A-I八种物质有 如图所示关系。每个方框表示有一种反应物或生成物(反应条件及生成的H2O已略去),其中A为单质,C为一种正盐,D、F为 气体,且D为最轻的气体,J为既不溶于水也不溶于酸的白色固体。
试回答下列问题:
(1)写出化学式:B ,C ,H 。
(2)写出反应②的化学方程式: 。
(3)写出离子方程式:
反应④: 。反应⑤: 。
20、下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回答下列问题:
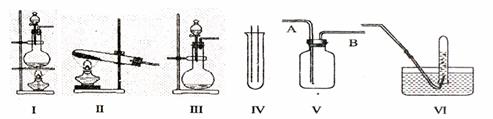
(1)若用MnO2与浓盐酸反应制取氯气,应选用装置 ,用方程式表示的制取氯气的反应原理是 。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的装置 ,完成下列离子方程式: MnO4-+ C1-+ H+ — Mn2++ C12↑+ 。
(3)若选用IV为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用 溶液浸湿,其作用是 。
(4)若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满了的方法是 。
19. 某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数
[方法一]加热转化法称取a克样品,置于硬质玻璃管中通入氧气加热一段时间。
(1)则硬质玻璃管中可能发生的化学反应方程式为 ;
(2)若冷却后称得固体质量为b克,则样品中Na2SO4质量分数为 ;
(3)该方法的缺点是 。(只要答一点)
[方法二]测 SO2质量法
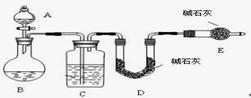
采用如图所示装置,通过实验测定生成SO 2的质量。
(1)若打开A装置的活塞时发现液体不能顺利留下,若装置无堵塞,则可能的原因是 。
(2)若实验前称取c克样品,测得SO2的质量为d克,则可求出Na2SO4质量分数,该方法的缺点是 。(只要答一点)
[方法三]测沉淀质量法
第一步:称取e克样品,置于小烧杯中;第二步:向小烧杯中加足量稀盐酸,加热;
第三步:向小烧杯中加足量BaCl2溶液,然后过滤、洗涤;第四步:干燥沉淀,称重为f克。
(1)方案中BaCl2不能改成Ba(NO3)2,试简述原因 。
(2)简述洗涤沉淀的方法: 。
18、A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
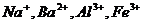 |
|
阴离子 |
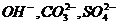 |
分别取它们的水溶液进行实验,结果如下:
①B中加入少量A产生白色沉淀,再加过量的A,沉淀量减少,但不会完全消失;
②C与E混合产生有色沉淀并放出无色气体;
③D与A混合,D与E混合均无明显现象。
试回答:⑴写出下列物质的化学式:
A C D
⑵写出下列反应的离子方程式:
①B溶液中加入过量的A溶液 ②C溶液与E溶液混合
17、(14分)以下是元素周期表的一部分,根据图示回答下列问题:
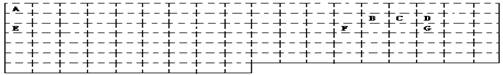
(1)请在表中用实线补全元素周期表的边界
(2)A、C形成的10电子阳离子的空间构型是________________;
写出工业上由GD2合成GD3 的化学方程式__________________________;
(3)E在D2中燃烧生成的化合物X中阴阳离子的个数比为___________ _;
X中的化学键类型是_________________;晶体类型是_______________。
(4)2.00gB2A2完全燃烧生成BD2和液态A2D,放出99.6KJ热量,写出B2A2燃烧热的热化学反应方程式__________________________________ _;
(5)BD2的电子式为______________;向含E的最高价氧化物的水化物0.05 mol的水溶液中通入标况下BD2气体1.12L,其反应离子方程式是_____________________。
16、将500mL pH=5的CuSO4溶液用惰性电极电解一段时间,溶液的pH变为2,若
使溶液的浓度、pH与电解前相同,可采取的方法是 ( )
A、向溶液中加入0.245g Cu(OH)2 B、向溶液中加入0.62g CuCO3
C、向溶液中加入0.0025mol H2SO4 D、向溶液中加入0.2g CuO
第Ⅱ卷(非选择题共52分)
15、向含有1mol的FeCl2溶液中通入0.2molCl2,再加入含0.1molX2O72-的酸性溶液
使溶液中Fe2+全部恰好氧化,并使X2O72-还原为Xn+,则n值为 ( )
A.2 B.3 C.4 D.5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com