
25.实验室有一瓶久置的白色粉末,经元素分析证明它由钾、硫、氧三种元素组成,钾和硫的质量比39:16,下列结论不正确的是
A.根据元素分析的结果推测该粉末有可能是纯净物
B.将粉末溶于水,加入氯化钡溶液,观察有白色的沉淀生成,证明原来的粉末是硫酸钾
C.将粉末溶于水,加入氯化钡和盐酸,观察到有白色沉淀和气泡产生,则原粉末可能是硫酸钾和亚硫酸钾的混合物
D.该粉末可能是硫化钾、硫酸钾和亚硫酸钾的混合物
Ⅱ卷
(共50分)
该部分从第26题到第29题,请考生用钢笔将答案直接写在答题卡相关区域。
24.能正确表示下列反应的离子方程式是
A.向偏铝酸钠溶液中滴加过量的碳酸氢钠溶液:AlO2-+4H+ Al3++2H2O
B.石灰水与足量碳酸氢钠溶液反应:HCO3-+Ca2++OH- CaCO3↓+H2O
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH- BaSO4↓+2H2O
D.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O Fe(OH)3↓+3H+
23.工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是: 2FeSO4=Fe2O3 + SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有①BaCl2溶液、②x溶液、③NaOH溶液的三个装置。则下列对该方案的评价中正确的是
A.①中会生成BaSO3、BaSO4两种沉淀
B.可将①中的BaCl2溶液改为Ba(NO3)2溶液
C.③的作用是检验生成的SO2气体
D.②所盛x应为品红溶液
22.下列事实所列出的相应结论正确的是
|
|
实验事实 |
结论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
|
D |
常温下白磷可自燃而N2须在放电时才与O2反应 |
非金属性:P>N |
21.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是
A.向CuSO4溶液中加入一小块金属钠
B.等物质的量浓度、等体积的(NH4)2SO4与BaC12溶液
C.等物质的量的NaHCO3与Na2O2固体
D.在NaBr溶液中通入少量氯气
20.为了确定下列物质是否被氧化,所选试剂(括号内物质)达不到实验目的的是
A.FeCl2溶液(KSCN溶液)
B.KI溶液(淀粉溶液)
C.HCHO溶液(紫色石蕊试液)
D.K2SO3溶液(BaCl2溶液).
19.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是:
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ③向AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③ C.①④ D.②③
18.某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论是
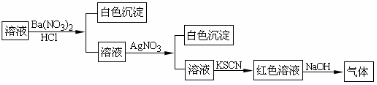
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
17.某溶液中,可能存在NH4+、Fe2+、Br-、CO32-、I-、SO32- 6种离子中的几种。①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝色。
根据以上实验事实推断,该溶液中肯定不存在的离子为
A.NH4+、Br-、CO32- B.NH4+、SO32-、I- C.Fe2+、I-、SO32- D.Fe2+、CO32-、I-
16.某物质A既可与稀酸溶液反应,又可与碱溶液反应并均可产生气体,下列对A成分推断中一定不正确的是
A.A可能是硅 B.A可能是(NH44 4)2SO4 C.A可能是铝 D.A可能是(NH4)2CO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com