
2x+3y=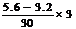 (得失电子守恒)得:x=0.06mol,y=0.04mol。则x∶y=3∶2。故选D。
(得失电子守恒)得:x=0.06mol,y=0.04mol。则x∶y=3∶2。故选D。
五、元素守恒
x+y=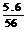 =0.1(Fe元素守恒)
=0.1(Fe元素守恒)
例4.某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,生成NO,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为 ( )
A.4∶1 B.2∶
[解析]:设Fe2+为xmol,Fe3+为ymol,则:
[解析]:当Fe3+、Al3+刚好全部转化为沉淀时,溶液为Na2SO4,该溶液显中性,所以n(Na+)=2n(SO42-)=2n(H2SO4)=0.01mol,即 n(NaOH)=0.01mol。所以c(NaOH)=0.1mol/L
[练习]:将mgAl2O3、Fe2O3的混合物溶解在过量的100ml0.05mol/LH2SO4溶液中,向其中加入NaOH溶液,使Fe3+、Al3+刚好全部转化为沉淀,用去NaOH溶液100ml,NaOH溶液的物质的量浓度是 mol/L。
例3.将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为
由题意得:Fe2O3与合金的质量相等,而铁全部转化为Fe2O3,故合金中Al的质量即为Fe2O3中氧元素的质量,则可得合金中铝的质量分数即为Fe2O3中氧的质量分数,O%=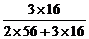 ×100%=30%,选B。
×100%=30%,选B。
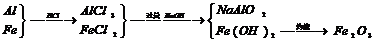 [解析]: 变化主要过程为:
[解析]: 变化主要过程为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com