
1.对巴厘岛区域特征的描述可信的是( )
A.岛内河流众多,水运价值极高
B.地势四周高中部低,森林覆盖率高
C.四季如春。降水丰沛
D.5月到g月比较凉爽,为旅游旺季
2.氨的合成
氮、氢混合气经过净化压缩以后进入合成塔.
观看flash
PPt投影:
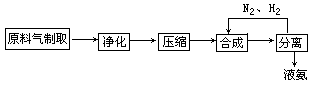
1.原料气的制备→净化→压缩
1、原料气的制取
(1)氮气
设问:合成氨所需的原料气是氮气和氢气.按照工业生产的特点,在工业上怎样制取氮气和氢气?
方法一(物理方法):氮气取自空气.将空气液化、蒸发,使它分离为氮气和氧气,氮气先逸出.
方法二(化学方法):使空气中的氧气跟炭作用,生成二氧化碳,再除去二氧化碳,即可得到氮气.
即:
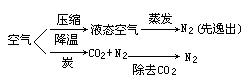
(2)氢气
电解水要耗用大量电能,制得的氢气成本太高,所以工业上不宜用电解水的方法制氢气.

提问:根据工业上制取原料气的化学方程式,合成氨工业需用哪些原料?
(根据学生的回答归纳.)
原料:空气、水和燃料
讲解:根据反应条件:
使用合适的催化剂--防止催化剂“中毒”--原料气要净化.
高压生产--氮、氢混合气要用压缩机压缩到高压.
小结:
4.浓度
增大反应物的浓度可以增大反应速率,减小生成物的浓度可以使平衡正向移动。因此可以用保持一定的氮、氢浓度,减少氨气的浓度的方法,提高合成氨的效率和产量。
实际生产中的处理方法:及时将气态氨冷却液化而分离出去;及时补充氮气和氢气,使其保持一定的浓度。
小结:合成氨的化学反应原理可以用以下化学方程式表示:
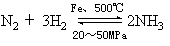
过渡:明确了合成氨工业的化学原理,接下来看看合成氨工业生产的主要流程是怎样的。
3.催化剂
设问:合成氨工业要求一定的温度和压强.既然催化剂不影响化学平衡,那么合成氨为什么必须使用催化剂?
分析:从反应物看,氮跟氢极不容易化合.即使在高温、高压下,反应速率可以大一些,但反应仍然十分缓慢.使用催化剂可以增大反应速率,缩短达到平衡所需的时间.
结论三:以铁为主体的多成分催化剂--铁触媒.
2.温度
设问:从化学平衡移动的角度分析,合成氨应采用低温,但是否温度越低越好呢?
学生回答后小结:在生产上既要有高的转化率,又要有较大的反应速率,这样才能缩短达到平衡所需要的时间,从而提高生产效率.如果温度过低,反应速率很小,需要很长时间才能达到平衡,这在工业上是很不经济的.所以合成氨工业温度不宜太低.
合成氨工业要使用催化剂.催化剂在一定的温度下,活性最大,催化能力最强.合成氨工业所需催化剂的最大活性温度是500℃.那么从催化剂的角度考虑,合成氨工业采取最适宜的温度--500℃左右
结论二:一般采用的温度是500℃左右.
1.压强
讲解:增大压强能加大化学反应速率,缩短达到平衡所需要的时间,又能使平衡向合成氨的方向移动,有利于提高反应混合物中氨的百分含量,所以合成氨一定要加大压强.
设问:从工业生产的实际考虑,合成氨工业所需的压强是否越大越好呢?
学生回答后小结:不是,因为压强越大,所需的动力越大;对材料的强度要求越高;对设备的制造要求越高。
我们要从化学反应原理方面分析,还要从动力、材料和设备几方面分析,才能确定合成氨工业的适宜压强.
结论一:一般采用的压强是20-50MPa.
练习:实验测得,每1mol氮气和3mol氢气反应,生成2mol氨气,能放出92.4kJ的热量.
(1)请写出合成氨的热化学方程式。
(2)根据热化学方程式和反应物的性质,分析合成氨的化学反应有哪些特点.
 解答:N2(g)+3H2(g) 2NH3(g)+92.4kJ
解答:N2(g)+3H2(g) 2NH3(g)+92.4kJ
教师归纳:氨的合成反应是放热的、气体总体积缩小的、很难发生的可逆反应.
提问:作为合成氨工厂的老总,你心目中理想的生产状态是怎样的呢?
--又快又多
分析:快--在单位时间里提高NH3的产量-反应速率问题
多--如何最大限度地提高平衡混合物中NH3的含量问题-化学平衡问题
引导学生讨论合成氨工业的生产条件,并填写表一中有关的内容。
|
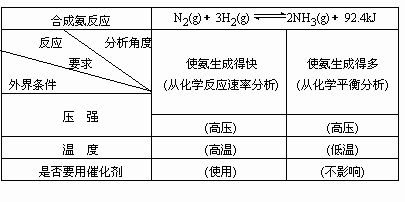
(利用表二)分析达到平衡时混合气中氨的含量,检查自己的判断是否正确.
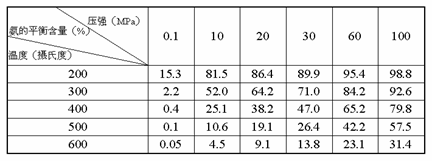

|
教师:从表一、二可以看出,从化学反应速率和化学平衡移动两方面分别考虑时,对压强的要求是一致的,而对温度的要求是矛盾的.
讲解:唯物辩证法告诉我们:一切从实际出发,要全面地分析问题.综合考虑化学反应速率和化学平衡移动的条件,再根据工业生产的特点和实际需要,才能正确地选择合成氨工业的适宜条件.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com