
24.(15分)TiO2在工业生产和日常生活中有重要用途。
I、工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
 其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:_________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。答: 。
II、TiO2可通过下述两种方法制备金属钛:
方法一是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
(5)方法二是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2 (s) +2Cl2 (g)  TiCl4(l) + O2
(g)
TiCl4(l) + O2
(g)
△H = +151 kJ·mol-1
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________________________。
23.(16分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
217 |
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表回答下列问题:
(1) 碲的化合价可能有_________________
(2) 氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_______________________________________。
(3) 工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
____A12Te3+_____( ) 一____A1(OH)3↓+____H2Te↑
 (4)已知在常温下,H2和S反应生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:_______________________
__________。
(4)已知在常温下,H2和S反应生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:_______________________
__________。
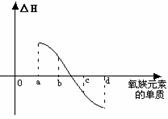
(5) 右图所示为上述表格中氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热。则:b代表________________,d代表_____________(均写单质名称)。
12.已知,同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则以下离子方程式错误的是( )
A. Cu2+ + H2S =CuS↓ + 2H+
B.Mg2+ + 2HCO3-+ 2Ca2+ + 4OH- =Mg(OH)2↓+ 2CaCO3↓+ 2H2O
C. Zn2+ + S2-+ 2H2O=Zn(OH) 2↓ + H2S↑
D.FeS + 2H+=Fe2+ + H2S↑
11.一定温度下,某密闭容器里发生如下反应:CO(g)+H2O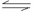 CO2(g)+H2(g)(正反应为吸热反应),当反应达到平衡时,测得容器中各物质的物质的量均为1 mol。欲使
CO2(g)+H2(g)(正反应为吸热反应),当反应达到平衡时,测得容器中各物质的物质的量均为1 mol。欲使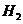 的物质的量浓度增大1倍,在其他条件不变时,下列措施中可采用的是
的物质的量浓度增大1倍,在其他条件不变时,下列措施中可采用的是
①升高温度 ②增大压强 ③再通入1 mol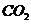 和1 mol
和1 mol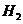 ④再通入2 mol CO和2 mol
④再通入2 mol CO和2 mol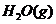
A.①② B.②④ C.③④ D.②③
10.下列说法正确的是 
A.0.2 mol/L NH4NO3 和 0.l mol/L NaOH 溶液等体积混合后:
c(NH4+) > c (NO3- ) > c (Na+) > c (OH-) >c (H+)
B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:
c(Na+)> c(CH3COO-)
C.浓度分别为0.1 mol·L-1和0.01 mol·L-1的CH3COOH溶液中:CH3COO﹣离子浓度前者是后者的10倍
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:
c(CH3COOH)+2 c (H+) = c(CH3COO-)+2 c (OH-)
9.根据有机化学相关知识,判断下列说法错误的是:
A.C2H4在一定条件下与水反应可得到C2H5OH
B.苯能与溴的四氯化碳溶液反应并褪色
C.淀粉和纤维素都是高分子化合物,在一定条件下水解能生成葡萄糖
D.用激光笔照射鸡蛋白质溶液,在垂直于光线的方向可观察到光亮通路
8.已知NH4CuSO3与足量的10mol/L硫酸液混合微热,产生下列现象:
①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。
据此判断下列说法正确的是 ( )
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.1mol NH4CuSO3完全反应转移0.5mol电子
7.下列叙述正确的是
①硫酸钡难溶于水和酸,可做X光透视肠胃的药剂
②蛋白质遇酒精会变性,医疗中用75%的乙醇溶液进行消毒
③棉花、蚕丝、人造羊毛的主要成分都是纤维素
④加酶洗衣粉是在洗衣粉中加入能使蛋白质水解的碱性蛋白酶,为了提高它的活性,洗衣服时温度越高效果越好
⑤碳酸钠、氢氧化钠、碳酸钙、碳酸氢钠等都可以中和酸,故都可以作为治疗胃酸过多的药物
⑥明矾净水利用了胶体的性质
⑦氢氟酸储存在玻璃瓶中
⑧可以用二氧化硅和水反应制备硅酸胶体
A.①②③⑦ B.①②⑥ C.①③④⑧ D.全都正确
6.常温下,用铂电极电解某溶液一段时间,该溶液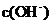 浓度减小,该溶液是( )
浓度减小,该溶液是( )
A.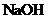 B.
B. C.
C.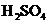 D.
D.
20、 如图所示,在光滑水平轨道上有一小车质量为M2,它下面用长为L的绳系一质量为M1的砂袋,今有一水平射来的质量为m的子弹,它射入砂袋后并不穿出,而与砂袋一起摆过一角度θ。不计悬线质量,试求子弹射入砂袋时的速度V0多大?
如图所示,在光滑水平轨道上有一小车质量为M2,它下面用长为L的绳系一质量为M1的砂袋,今有一水平射来的质量为m的子弹,它射入砂袋后并不穿出,而与砂袋一起摆过一角度θ。不计悬线质量,试求子弹射入砂袋时的速度V0多大?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com