
7.下列实验操作正确的是( )
A.实验室用高锰酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯
B.将粗盐加到盛有10mL水的量筒中,用玻璃棒搅拌使其溶解
C.先将pH试纸用蒸馏水润湿后,再测定溶液的pH
D.先用双手紧捂试管,再将导管一端浸入水中检查装置的气密性
6. 用“王水”(浓盐酸与浓硝酸的混合物)溶解黄金后得到一种物质:HAuCl4(四氯合金酸),其中金元素的化合价为 ( )
A.+1 B.+2 C.+3 D.+4
5.下列物质的用途主要是由其化学性质决定的是 ( )
A.用盐酸除铁锈 B.用铜抽成丝做电线
C.用铝作导热材料 D.用氦气填充气球
4.某原子结构示意图为 ,它的最外层电子数是( )
A.2 B.4 C.6 D.8
3.吸烟有害健康,烟气中含有能与血液中血红蛋白结合的有毒气体,它是( )
A.氮气 B.一氧化碳 C.二氧化碳 D.氧气

2.下列物质中属于纯净物的是 ( )
A.啤酒 B.蒸馏水 C.合金 D.鸡汤
1.下列变化不属于化学变化的是( )
A.粉碎矿石 B.高炉炼铁 C.食物腐烂 D.光合作用
29.(13分)已知:一个碳原子上连有两个羟基时不稳定,易发生下列转化:

某烃A的蒸气密度是相同状况下氢气的53倍,烃A不能使溴的CCl4溶液褪色,但能使酸性KMnO4溶液褪色。氢原子核磁共振谱图表明A有2个吸收峰,强度之比为3∶2,B只有1
个吸收峰,D有2个吸收峰,G为环状结构。A可以发生如下图所示的一系列变化(生成的其它无机物均未写出)。请回答下列问题:
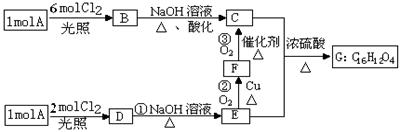
(1)A的分子式是__。
(2)指出下列反应的反应类型:①_、。
(3)写出B、G的结构简式: G_。
(4)写出下列反应的化学反应方程式:反应②_;
C和E还能生成高分子化合物,请写出其反应的化学方程式_。
(5)写出满足下列条件的E的所有同分异构体的结构简式(E不必再写): _。
①遇FeCl3溶液显紫色;②能发生消去反应生成碳碳双键。
30.[化学--物质结构与性质](13分)
短周期元素X、Y、Z、W原子序数依次增大。已知W与X原子最外层都只有1个S电子,二者电子层数之差为2;Y原子最外层S电子与P电子数相等,其电子层数与内层电子数相等;Z原子S电子与P电子数相等。
(1)Z原子的电子排布式为 。
(2)X与Y两种元素构成的最简单的化合物分子的空间构型是 结构,这种结构的分子中的中心原子一般采用 杂化轨道形成化学键。由X和Y形成的化合物Y2X2分子的共价键有 个σ键和 个π键。
(3)Z与W以原子个数比1:1形成的化合物的化学式是 ,该化合物固态时属于 晶体,形成该晶体的化学键有 。
(4)X与Z形成的化合物X2Z的结构式为 ,该物质的沸点比较高,其主要原因是 。
28.(15分)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度, 防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe
2+。实验步骤如下:
防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe
2+。实验步骤如下:
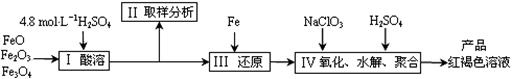
(1)实验室用18.4 mol·L-1的浓硫酸配制250mL4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种带有刻度的移液管)外,还需_▲_。
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是_▲_。
A.控制溶液中Fe2+与Fe3+含量比 B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用NaClO3氧化时的离子方程式_▲_(提示:ClO3-转化为Cl-);
已知1mol HNO3的价格为0.16元,1mol NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是_▲_,弊是_▲_。
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+ 物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g。
(b)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000 mol/L KMnO4标准溶液VmL。反应的离子方程式为:5Fe2+ + MnO4-+ 8H+ = 5Fe3+ + Mn2+ + 4H2O
回答下列问题:
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是_▲_;
②在(b)步骤中判断达到终点的现象是_▲_;
③聚合硫酸铁中SO42-与Fe3+的物质的量之比为_▲_(用含m、V的代数式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com