
31. 某化肥厂氨和空气(设氧气的体积分数为0.2,空气式量为29)生产硝酸铵过程如下:

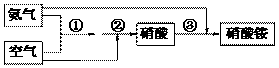
其中①、②的反应方程式为:4NH3 + 5O2 --→ 4NO+6H2O, 4NO+3O2+2H2O → 4HNO3
(1)若原料气的密度为1.25g/L(标准状况),则氨气与空气的体积比_________。
(2)若生产硝酸的氨气与空气中的氧气恰好完全反应,且硝酸全部溶解反应产生的水中,所得硝酸溶液的物质的量浓度为____________(保留2位小数,此时硝酸溶液的密度为1.38g/cm3)。
(3)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨气(包含第③步被硝酸吸收的氨气)的体积分数最大值为____________。
(4)若实际生产中,反应①的转化率为94%,反应②的转化率为97%,反应③中氨的转化率为98%,硝酸完全转化。求(写出计算过程):
(i)100 m3(已折算到标准状况)氨气最多可生产硝酸铵的质量(kg)。
(ii)合成硝酸铵的整个流程中,氨的总转化率。
30. 有CH4和CO的混合气体共0.5mol,在足量氧气中充分燃烧,生成物用足量碱石灰吸收,碱石灰增重25.6 g。
(1)原混合气体中碳原子与氢原子的个数比是____________。
(2)若用足量的Na2O2吸收燃烧后的混合气体,Na2O2将增重___________ _g。
_g。
29. 2004年国家食品监督局发出公告“警惕油炸食品中的丙烯酰胺(CH2 = CH-CONH2)”,丙烯酰胺对人体可造成神经毒性和遗传毒性。下图流程中的有机物K是丙烯酰胺的相邻同系物。
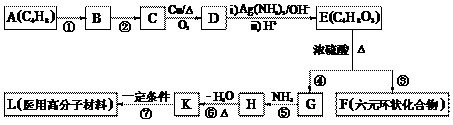
请回答下列问题:
(1)① ~ ⑦反应中属于加成反应的有 ___________,属于消除反应的是 ___________。
(2)写出反应条件 ② _____________________。
(3)写出结构简式 B ______________________,H ______________________。
(4)写出下列反应的化学方程式:
C→D _____________________________________________________________
E→F ______________________________________________________________
(5)反应③除生成F、G外,还可能生成其它副产物,任写其中两种不同类别产物的结构简式________________________________,___________________________________。
28. 苯佐卡因是一种医用麻醉药品,学名对氨基苯甲酸乙酯。用芳香烃A为原料合成苯佐卡因E的路线如下:
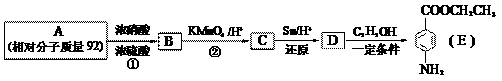
请回答:
(1)写出结构简式 B ________________ C _________________。
(2)写出反应类型 ① _______________ ② ________________。
(3)化合物D经聚合反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。写出该聚合反应的化学方程式:_____________________________________________。
(4)下列化合物中能与E发生化学反应的是_________。
a. HCl b. NaCl c. Na2CO3 d. NaOH
 (5)除
(5)除 、
、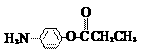 、
、 外,符合下列条件的化合物E的同分异构体有_____种。
外,符合下列条件的化合物E的同分异构体有_____种。
i. 为1,4-二取代苯,其中苯环上的一个取代基是氨基;ii. 分子中含 结构的基团
27. 实验室欲制取少量NaHCO3与NH4Cl。实验步骤如下:

请回答:
(1)步骤I、III中需用到氨气,下列装置可用于实验室制氨气的是_________。(填序号)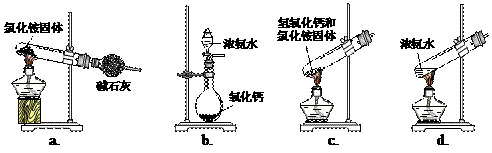
|
(2)写出步骤I中发生的化学反应方程式 _______________________________________________________。 若用右图装置进行该沉淀反应。实验时,须先从_____(填“a”、“b”或“c”)管通入_____气体。 |
 |
(3)步骤III向滤液中通入氨气,加入细小食盐颗粒,可使NH4Cl晶体单独结晶析出。
 ①此处通入氨气的
①此处通入氨气的 作用是_________。
作用是_________。
a. 增大NH4+的浓度,使NH4Cl更多地析出
b.  使NaHCO3更多地析出
使NaHCO3更多地析出
c. 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
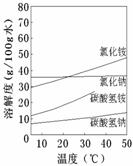
②已知四种相关物质不同温度下的溶解度曲线如图所示。
结晶时宜采用___________(填“蒸发结晶”或“降温结晶”)。
③有人设计了如下图所示的装置来验证所得的晶体中含有NH4+。
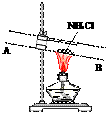 具体操作:取少量晶体于硬质试管,对晶体部位加热。并在_____
具体操作:取少量晶体于硬质试管,对晶体部位加热。并在_____
(填“A”或“B”)处放置______________试纸,观察现象。
(4)请按提示完成NaHCO3含量分析的实验设计。
试剂:盐酸、澄清石灰水、氢氧化钡溶液、蒸馏水;
仪器:电子天平、烧杯、漏斗、玻璃棒、干燥器等
① _________________溶于水,加入__________________________。
②过滤、洗涤、烘干,冷却、称量,并进行_____________操作(写操作名称)。
③计算。若数据处理时将所得固体质量1.977 g错看为1.971 g,由此产生的相对误差为_ ____。
26. 利用Y型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
|
(1) |
 |
实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为________________;硫化亚铁处加水的目的是___________________。 |
|
(2) |
 |
实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧Y型管中应放置的药品是_________、_________(必要时可以加热),该沉淀的化学式为____________。 |
|
(3) |
 |
实验目的:探究电石气中的成分 ① 装置A中的化学反应方程式为: _________________________________________。 ②B装置中出现黑色沉淀,可判断电石气中含有________;C装置的作用为__________________。 ③为验证电石气的主要成分,D中盛放________。 |
|
(4) |
 |
实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是__________ _________________________________________。 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1. 00mL,末读数为45.80mL  ,则合金中铁的含量为________%(保留2位小数,已折算标况)。 ,则合金中铁的含量为________%(保留2位小数,已折算标况)。 |
25. 1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)  Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
(1)该反应的平衡常数表达式为____________________。
已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
 (2)该温度下,在2L盛有1.42 g
Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。
(2)该温度下,在2L盛有1.42 g
Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。
(3)能说明该反应已达到平衡状态的是______(填序号)。
a. 容器内压强保持不变 b. 容器内气体密度保持不变
c. c(H2) = c(H2O) d. υ正(H2) =υ逆(H2O)
(4)向平衡体系中加入焦炭,下列图像正确的是___________(填序号)。
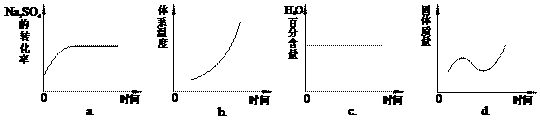
(5)用有关离子方程式说明上述反应产物水溶液的酸碱性_______________________,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是____________________。
24. 作为世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处
|
理领域有着广泛应用。与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。 (1)反应时,ClO2生成ClO2-、Cl-的转化率与溶液的pH的关系如图所示。则pH= 8时,ClO2被还原为_____________。 |
 |
(2)亚氯酸根离子(ClO2-)对人体不利。欲在弱碱性条件下将水中的ClO2-转化为Cl-除去,若该反应体系中的物质有:NaClO2、Fe(OH)3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出、配平有关化学方程式,并标出电子转移的方向和数目:
______________________________________________________ ___________。
___________。
(3)以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:2NaClO3 + H2O2 + H2SO4 → 2ClO2↑+ O2↑+ Na2SO4 + 2H2O
① 方法一,当有0.2mol电子 发生转移时,参与反应的还原剂为_________ mol。
发生转移时,参与反应的还原剂为_________ mol。
② 方法二:该反应中H2O2_________(填序号)。
a. 发生氧化反应 b. 仅做氧化剂 c. 既被氧化又被还原 d. 既未被氧化也未被还原
③ 用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是___________________。
23. 组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有______(写元素符号),它的原子最外层共有______种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置_______________________。
(2)糖类是人体获得能量的来源之一。已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式________________________________。
(3)CO2是一种温室气体,它的电子式为______________,将其转变其他化工原料,必须破坏的化学键属于_________(填“极性”或“非极性”)键。
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是______(填序号)。
a. 离子半径:S2->Na+>O2->H+ b. 与水反应的剧烈程度:K>Na>Mg>Ca
c. 熔点:CO2>SiO2>Na2O>SO3 d. 还原 性:PH3>H2S>HCl>HF
性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:
|
共价键 |
H-H |
H-F |
H-Cl |
H-Br |
H-O |
H-S |
H-N |
H-P |
|
键长(pm) |
74 |
92 |
127 |
141 |
98 |
135 |
101 |
321 |
|
键能(kJ/mol) |
436 |
568 |
432 |
368 |
464 |
364 |
391 |
142 |
根据表中数据,归纳共价键键能与键长的关系 _______________________________。
22. 向200 mL 0.1mol/L 的F e(NO3)2溶液中加入一定量NaOH,使Fe2+完全沉淀,加热、蒸干并灼烧混合物直至质量不再变化,此时固体的质量可能为
e(NO3)2溶液中加入一定量NaOH,使Fe2+完全沉淀,加热、蒸干并灼烧混合物直至质量不再变化,此时固体的质量可能为
A. 1.60 g B. 2.76 g C. 4.36 g D. 5.54 g
第II卷(共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com