
11.以水为溶剂进行中和滴定的原理是:H3O++OH--→2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+ SO2(l)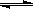 SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
A.该滴定反应可以表示为:SO32-
+ SO2+ → 2SO2 B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数 C.自离解的存在,说明SO2是离子化合物 D.可通过导电能力变化来判断是否到达滴定终点
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
A.该滴定反应可以表示为:SO32-
+ SO2+ → 2SO2 B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数 C.自离解的存在,说明SO2是离子化合物 D.可通过导电能力变化来判断是否到达滴定终点
10.根据下列实验内容得出的结论正确的是
|
选项 |
实验内容 |
结论 |
|
A |
某物质的水溶液能使红色石蕊试纸变蓝 |
该物质一定是氨气 |
|
B |
某物质的水溶液中加入盐酸产生无色无气味气体 |
该溶液一定含有大量碳酸根离子 |
|
C |
测定同浓度的Na2CO3
和Na2SO4
溶液pH,前者大于后者 |
碳元素非金属性弱于硫 |
|
D |
向沸水中逐滴加入1-2mL FeCl3饱和溶液,搅拌并继续煮沸出现浑浊 |
制备Fe(OH)3胶体 |
9. 右图中,两电极上发生的电极反应为: a极:Cu2++2e-=Cu
b极:Fe-2e-=Fe2+下列说法不正确的是
A.装置中电解质溶液一定含有Cu2+ B.该装置一定是化学能转化为电能
C.a、b可能是同种电极材料 D.a极上一定发生还原反应
右图中,两电极上发生的电极反应为: a极:Cu2++2e-=Cu
b极:Fe-2e-=Fe2+下列说法不正确的是
A.装置中电解质溶液一定含有Cu2+ B.该装置一定是化学能转化为电能
C.a、b可能是同种电极材料 D.a极上一定发生还原反应
1.0×10-amol·L-1和是1.0×10-bmol·L-1,在此温度时,水的离子积为1.0×10-(b+a)
8.下列叙述正确的是
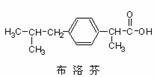
A.布洛芬结构中的氢原子若被氯原子取代,其一氯代物都只有2种
B.已知反应mX(g)+nY(g)  qZ(g)
,若平衡时X、 Y的转化率相等,说明反应开始时X、Y的物质的量之比为1:1
qZ(g)
,若平衡时X、 Y的转化率相等,说明反应开始时X、Y的物质的量之比为1:1
C.1 L 1 mol/L Na2CO3溶液中含有3×6.02×1023个离子
D.在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是
7.下列说法正确的是
A.K+ 、Cr2O72-、NO3-、Cl- 大量共存的溶液,一定是无色溶液B.活化能越大的化学反应,其反应热不一定越大 C.因为NH4Cl是强电解质,所以在其水溶液中只存在水解平衡,不存在电离平衡
 D.CH3COOH与NaOH溶液恰好完全反应时,c(CH3COO-)
= c(Na+)
D.CH3COOH与NaOH溶液恰好完全反应时,c(CH3COO-)
= c(Na+)
6.下列说法正确的是
A.富含蛋白质的食物多属于酸性食物B.钢铁在海水中比在河水中更易被腐蚀主要原因是海水含氧量高于河水
C.蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖D.凡含有食品添加剂的食物对人体健康均有害不宜食用
28.(16分)
已知: (R、R’表示烃基或官能团)
(R、R’表示烃基或官能团)
有机物A是一种医药中间体,质谱图显示其相对分子质量为130。已知0.5 mol A完全燃烧只生成3 mol CO2和2.5 mol H2O。A可发生如下图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成六元环状酯类化合物。

请回答:
(1)1 mol B与足量的金属钠作用产生22.4 L(标准状况)H2。B中所含官能团的名称是 ▲ 。B与C的相对分子质量之差为4,B→C的化学方程式是▲ 。
(2)D的同分异构体G所含官能团与D相同,则G的结构简式可能是▲ 、▲ 。
(3)F可发生多种类型的反应。
①两分子F反应生成的六元环状酯类化合物的结构简式是 ▲ ;
②F可制得使Br2的CCl4溶液褪色的有机物H。F→H的化学方程式是 ▲ ;
③F在一定条件下发生缩聚反应的化学方程式是 ▲ 。
(4)A的结构简式是 ▲ 。
27. (16分)氯气是一种重要的工业原料。(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 ▲ 。(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4
(16分)氯气是一种重要的工业原料。(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 ▲ 。(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4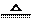 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
①在该实验中,甲部分的装置是 ▲ (填字母)。
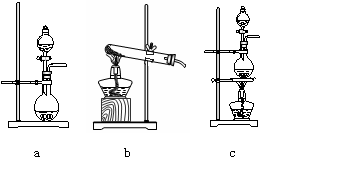
②乙装置中FeCl2溶液与Cl2反应的离子方程式是 ▲ 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是 ▲ 。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是 ▲ 。
④该实验存在明显的缺陷,改进的方法是 ▲ 。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1 Na2S2O3溶液:2Na2S2O3+I2= Na2S4O6+2 NaI,共消耗20mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为 ▲ 。
26.(12分)氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是 ▲ 。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 ▲ 。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是 ▲ 。
(3)已知:① CH4(g) + 4 NO2(g) = 4 NO(g) + CO2(g) +2 H2O(g) △H= -574 kJ·mol-1
② CH4(g) + 4 NO(g) = 2 N2(g) + CO2(g) + 2 H2O(g) △H= -1160 kJ·mol-1
 根据①和②,标准状况下,4.48 L CH4恰好将NO2转化为N2时,△H= ▲ 。
根据①和②,标准状况下,4.48 L CH4恰好将NO2转化为N2时,△H= ▲ 。
关于①和②,下列说法正确的是 ▲ (填字母)。
a.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)
△H<-574 kJ·mol-1
b.等物质的量的甲烷分别发生反应①、②,转移电子数相同
c.右图可表示①的反应过程和能量关系
(4)同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气完全转化为N2,则原混合
气中 NO和NO2的体积比是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com