
26.(14分)氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为 。
 (2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
有关键能:N=N945.6kJ/mol N-H391.0kJ/mol,则H-H键能为 。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为 。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
|
物质 |
△H(kJ/mol) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式 。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式 。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
,溶液中离子浓度从大到小的顺序是 。
 27.(14分)某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):
27.(14分)某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,
观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是 。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气体积的关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中的一种方法 。
25.(15分)下表是元素周期表的一部分,A、B、C、D、E、X、Y是一表中给出元素组成的常见单质或化合物。

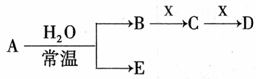 I.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
I.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为氧化物,则A的化学式为 ,A与水反应的化学方程式为 。
①当X是碱性盐溶液,C分子中有22个电子时,则C的电子式为 ,表示X呈碱性的离子方程式为 。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为 。
(2)若E为单质气体,D为白色沉淀,A的化学式可能是 ,B含有的化学键类型为 ,C与X反应的离子方程式为 。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式 。t°C时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为 。
II.元素周期是人们研究物质性质的重要工具。
(1)As在周期表中的位置 。
(2)As的原子结构示意图为 ,其氢化物的化学式为 。
(3)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂。As可与Y的水溶液反应,生成As最高价含氧酸,该反应的化学方程式为 ,当消耗1mol还原剂时,电子转移了 mol。
12.某化学小组欲探究①溴乙烷在不同溶剂中与NaOH发生不同类型的反应;②某CuO和Cu混合粉末中CuO的质量分数。下列实验设计方案及预期结论合理的是 ( )
|
|
探究 |
方案 |
结论 |
|
A |
① |
取2mL溴乙烷,加入适量NaOH水溶液,加热。一段时间后,向溶液中滴加AgNO3溶液,有淡黄色沉淀产生 |
溴乙烷中的溴变成了Br-,溴乙烷与NaOH水溶液发生取代反应 |
|
B |
① |
取2mL溴乙烷,加入适量NaOH乙醇溶液,加热,将产生的气体通入KMnO4酸性溶液中,溶液褪色 |
反应生成乙烯,溴乙烷与NaOH乙醇溶液发生消去反应 |
|
C |
② |
称取质量为m1的混合物,在空气中加强热至质量不再变化,冷却、称量,所得固体质量为m2 |
CuO的质量分数为: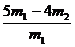 |
|
D |
② |
称取质量为m1的混合物,放入足量稀硝酸中溶解,过滤、洗涤、干燥、称量,残留固体质量为m2 |
CuO的质量分数为: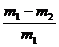 |
第Ⅱ卷(非选择题 共180分)
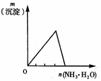
11.下列反应中,相关示意图像错误的是 ( )
|
A |
B |
C |
D |
|
将二氧化硫通入到一定量氯水中 |
将氨水滴入到一定量氯化铝溶液中 |
将铜粉加入到一定量浓硝酸中 |
将铁粉加入到一定量氯化铁溶液中 |
|
|


10.CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜 片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量的酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是 ( )
①铜片做阴极,石墨做阳极 ②铜片做阳极,石墨做阴极
③阳极有氧气生成 ④阴极有氢气生成
⑤白色沉淀在阳极附近生成 ⑥白色沉淀在阴极附近生成
⑦阳极区溶液变蓝的原因是2Cu+4I――4e-=2CuI↓+I2 碘遇淀粉变蓝
⑧阳极区溶液变蓝的原因是4OH――4e―=2H2O+O2↑O2将I-氧化为I2,碘遇淀粉变蓝
A.只有②④⑤⑦ B.只有①④⑥⑦ C.只有②③⑤⑧ D.只有①③⑥⑧
9.下列叙述错误的是 ( )
A.把aL0.1mo1/L的CH3COOH溶液与b L 0.1 mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-)
B.把0.1mol/L的NaHCO3,溶液与0.3 mol/L的Ba(OH)3溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba+)>c(Na+)>c(H+)
C.向1mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高
D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
8. 某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g) 2NH3
(g) △H<0。
某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g) 2NH3
(g) △H<0。
下列分析正确的是 ( )
A.平衡后加入N2,该反应的△H增大
B.若平衡昏升高温度,则平衡常数K变大
C.平衡后再充入NH3,达到新平衡时,NH3的百分含量变大
D.若反应前充人的N2与H2物质的量相等,达平衡时N2的转化率比H2的高
7.下列叙述中正确的是 ( )
A.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B.向Fel2溶液中通入少量Cl2,再滴加少量CCl4,振汤、静置,下层液体为紫色
C.向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收
D.将SO2气体通入溴水,欲检验是否有SO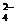 生成,可向溶液中滴加Ba(NO3)2溶液
生成,可向溶液中滴加Ba(NO3)2溶液
6.化学与生活密切相关,下列说法错误的是 ( )
A.“加铁酱油”可有效预防缺铁性贫血
B.维生素C具有还原性,在人体内起抗氧化作用
C.蛋白质水解产物氨基酸可以合成人体所需蛋白质
D.食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯
2010.4
以下数据可供解题时参考:
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cu 64
第I卷(选择题 共120分)
本卷共20小题,每小题6分,共120分。在每小题列出的四个选项中,选出符合题目要求的一项。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com