
26.(14分)下图为某套实验装置示意图,其中加热装置和部分药品等已经省略(装置①和装置②为气体发生装置)。
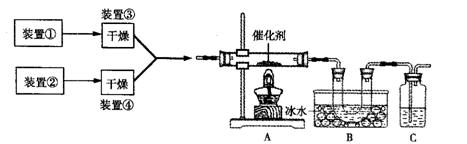
(1)甲同学利用装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。A装置中相应药品在催化加热时发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学利用此套装置合成SO3,B处冰水冷却的U型管中的固体出现。C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)

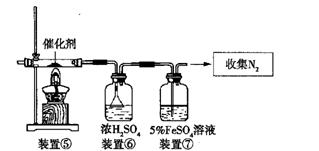 (3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016Mln2,则NO的转化率是
(能正确表达出计算过程即可)
25.(16分)
经质潜法分析得知,某单烯烃Q的相对分子质量为56;其核磁共振氢谱与红外光谱表明,Q分子中有两种化学环境不同的氢原子,氢蘑峰面积显示两种氢的原子个数比为1:3(Q分子中含有支链)。
(1)O的结构简式为 。
(2)在锂离子电池中,需要一种有机聚合物作为正负极之问锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如右:
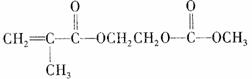
M的合成方法之一如下:
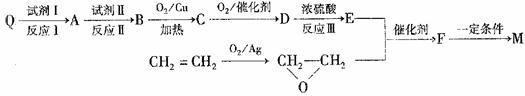
请回答下列问题:
①合成M的反应中,反应I和反应III的反应类型分别是 、 ;
试剂Ⅱ是 ,C中含有官能团的名称是 。
②E的结构简式是 。
③M与足量氯氧化钠溶液反应的化学方程式是 。
(3)D在一定条件下?能发生缩聚反应生成高聚物,请写出D发生缩聚反应的化学方程式 。
(4)已知:I.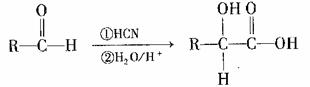 (其中R为烃基)
(其中R为烃基)
II.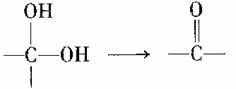
若 ,请写出符合下列条件的物质的一种结构简式
。
,请写出符合下列条件的物质的一种结构简式
。
a.碳骨架与w相同;
b.能发生银镜反应;
c.1mol该物质与足量金属钠作用生成1.5molH2;
d.分子中每个碳原子上不同时连有两个官能团。
12.已知:可逆反应N:(g)+3H2(g)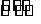 2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2mol
NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是( )
2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2mol
NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是( )
A.达平衡时甲中N:的转化率为75%
B.达平衡时甲、乙中NH,的体积分数乙>甲
C.达到平衡后,再向乙中加入0.25mol N2(g)、0.75mol H2(g)和1.5mol NH3(g),平衡向生成N2的方向移动
D.乙中反应的热化学方程式为2NH3(g)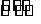 N2(g)+3H2(g)△H=+Q2kJ/mol
N2(g)+3H2(g)△H=+Q2kJ/mol
11.25℃时,下列溶液中微粒的物质的量浓度关系正确的是 ( )
A.等物质的量浓度的H。s和NaHS混合溶液中:
c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.pH =3的一元酸HA与pH=11的NaOH溶液等体积混合后:
c(Na+)>c(A-)>c(OH-)>c(H+)
D.0.4mol/L NH4Cl和0.2mol/L NaOH两种溶液等体积混合后pH=9:
c(NH+4)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
10.下列实验现象、操作或反应原理的解释正确的是 ( )
|
现象、操作或反应 |
解释 |
|
A.铝箔在酒精灯火焰上加热熔化不滴落 |
铝箔对熔化的铝有吸附作用 |
|
B.向滴有稀硫酸的热淀粉液中滴加碘水,液体呈蓝色 |
淀粉在此条件下未水解 |
|
C.向盛有足量Zn和稀硫酸的试管中滴加少量硫酸铜溶液 |
形成锌铜原电池,使反应速率加快 |
|
D.鸡蛋清溶液遇乙酸铅溶液会产生沉淀 |
蛋白质发生盐析 |
9.下列各组溶液中,只用括号内的试剂及物质问相互反应无法鉴别的一组是 ( )
A.Ba(OH)2、KSCN、NaCl、K2SO4(FeCl3溶液)
B.NaNO3、NaHCO3、Na2SO3、Na2SiO3(H2SO4溶液)
C.NaBr、HCl、KI、CaCl2(AgNO3溶液)
D.NH4Cl、Mg(NO3)2、CuSO4、AlCl3(KOH溶液)
8.W、X、Y、z均为短周期主族元素。X为地壳中含量最多的元素;W的原子最外层电子数与核外电子总数之比为7:17;含Z元素的物质焰色反应为黄色;Y的原子序数是W和Z的原子序数之和的一半。下列判断正确的是 ( )
A.Y的氧化物既可溶于W氢化物的水溶液,又可溶于Z的氢氧化物水溶液
B.氢化物的沸点:X<W
C.元素Z与X形成的化合物中一定含有离子键和共价键
D.电解ZW水溶液一段时间后,溶液pH增大
6.下列有关生活中化学知识的描述错误的是 ( )
A.维生素C也称为抗坏血酸,补铁时常同时服用
B.阿司匹林是一种重要的人工合成药物,是一种有机酸,具有解热镇痛等作用
C.高压锅、易拉罐、硬币等生活中常见物品都是由纯金属制成的
D.混凝法、中和法和沉淀法是污水处理中常用的化学方法
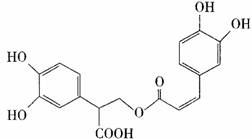 7.迷迭香酸有很强的抗氧化性,对癌症和动脉
7.迷迭香酸有很强的抗氧化性,对癌症和动脉
硬化的预防起到一定作用,其结构如右图
所示。下列叙述正确的是 ( )
A.迷迭香酸的分子式为C18H15O8
B.迷迭香酸可以发生加成、取代、消去、
显色反应
C.1mool迷迭香酸跟H2反应,最多消耗
8mol H2
D.1tool迷迭香酸与足量NaOH溶液反应,最多消耗6mol NaOH
2010.4
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共300分。考试时长150分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将本试卷和答题卡一并交回。
以下数据可供解题时参考:可能用到的相对原子质量:H 1 C 12 N 14 O 16
第Ⅰ卷(选择题共120分)
28.(15分)以石油裂解气为原料,通过一系列化学应可得到重要的化工产品增塑剂G。
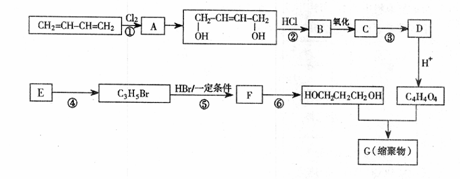
(1)E是一种石油裂解气,能使酸性高锰酸钾溶液褪色。同温同压下,E的密度是H2的21倍。核磁共振氢谱显示E有3种不同化学环境的氢原子,其个数比为1:2:3。E的结构简式为 。
(2)反应类型:① ,④ 。
(3)反应条件:③ ,⑥ 。
(4)反应②、③的目的是 。
(5)反应⑤的化学方程式为 。
(6)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。
(7)G的结构简式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com