
25.(16分)肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。它的核磁共振氢谱图上有6个峰,峰面积之比为1:2:2:1:1:3。它的红外光谱如下图:
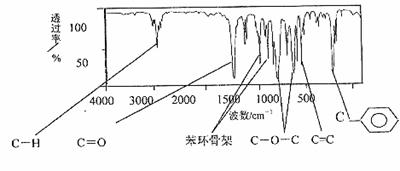
试回答下列问题:
(1)肉桂酸甲酯的结构简式是 。
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示
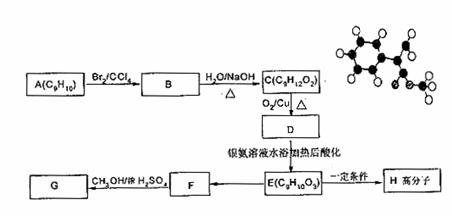 (图中球与球之间连线表示单键或双键)。
(图中球与球之间连线表示单键或双键)。
用芳香烃A为原料合成G的路线如下:
①化合物E中的官能团有 (填名称)。
②A→B的反应类型是 。
③化合物F是否有顺反异构体 (填“有”或“没有”)。
④书写化学方程式
C→D 。
 E→H
。
E→H
。
⑤E的同分异构体甚多,其中有一类可用通式 表示(其中X、Y均
不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式 、 。
12.在AlCl3和FeCl3的混合液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是 ( )
A.Fe2S3、I2 B.Al(OH)3、I2
C.Fe(OH)3、Al(OH)3 D.FeS、S、Al(OH)3
第II卷(非选择题 共11小题 共180分)
11.在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入B g该盐,保持温度不变,析出R结晶水合物W g,从原饱和溶液中析出溶质R的质量为 ( )
A.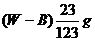 B.
B.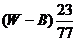 C.
C.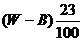 D.
D.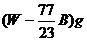
10.已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O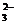 +4OH-=Fe3O4+S4O
+4OH-=Fe3O4+S4O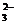 +2H2O,下列说法正确的是 ( )
+2H2O,下列说法正确的是 ( )
A.O2和S2O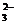 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B.每生成1mol Fe3O4,则转移电子数为2mol
C.参加反应的氧化剂与还原剂的物质的最之比为1:1
D.若有2mol Fe2+被氧化,则被e2+还原的O2为0.5mol
9.下列说法正确的是 ( )
A.某温度时,pH=6的纯水,含10-6×6.02×1023个OH-
B.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023
C.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数必为0.5×6.02×1023
D.V L a mol/L的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023
8.下列离子方程式书写正确的是 ( )
A.甲醛和足量银氨溶液充分反应:
|
 HCHO+2Ag(NH3)
HCHO+2Ag(NH3)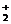 +2O
+2O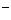 HCOO
HCOO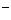 +NH
+NH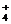 +2Ag↓+H2O
+2Ag↓+H2O
B.向含有硫酸钙的水垢中加入碳酸钠溶液,沉淀的转化可表示为:
 CaSO4(s)
SO
CaSO4(s)
SO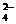 +Ca
+Ca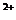
+
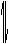 CO
CO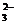
CaCO3(s)
C.酸性条件下KIO3溶液与II溶液发生反应生成I2:IO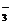 +SI
+SI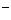 +3H2O=3I2+6OH
+3H2O=3I2+6OH
D.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br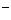 +Ag
+Ag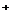 =AgBr↓
=AgBr↓
6.2009年世界气候大会在丹麦首都举行。控制二氧化碳排放,需要从人人做起,“低碳生活”有望成为新的时尚流行全球。“低碳生活”是指生活作息时所耗用能量要减少,从而降低碳特别是二氧化碳的排放。下列行为不利于低碳生活的是 ( )
A.用大排量的轿车代替公交车出行
B.将碳进行气化处理,提高煤的综合利用率
C.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的正复使用(Reuse)、资源的重复再生(Recycle)
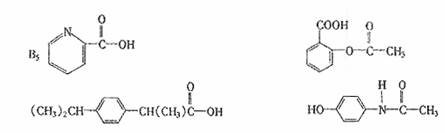 7.一定条件下,下列药物的主要成分都能发生:取代反应、加成反应、水解反应和中和反应的是 ( )
7.一定条件下,下列药物的主要成分都能发生:取代反应、加成反应、水解反应和中和反应的是 ( )
①维生素 ②阿斯匹林
③芬必得 ④扑热息痛
A.①④ B.②④ C.①③ D.③④
28.(16分)
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定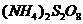 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:
[实验原理] 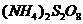 和KI反应的离子方程式为:
和KI反应的离子方程式为: 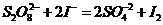 (1)
(1)
平均反应速率的计算式为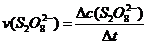 。
。
实验时,向 、
、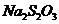 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入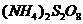 溶液,不断搅拌。
溶液,不断搅拌。
在反应(1)进行的同时,发生反应: 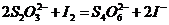 (2)
(2)
反应(1)生成的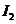 立即与
立即与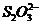 反应,生成无色的
反应,生成无色的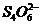 和
和 。
。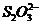 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的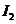 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入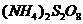 溶液到出现蓝色的时间为
溶液到出现蓝色的时间为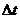 。
。
[实验内容]
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
|
试剂 用量 (mL) |
0.20 mol·L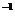 (NH4)2S2O8 溶液 (NH4)2S2O8 溶液 |
20.0 |
10.0 |
b |
20.0 |
20.0 |
0.20 mol·L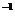 KI溶液 KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
0.010 mol·L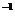 Na2S2O3溶液 Na2S2O3溶液 |
a |
8.0 |
8.0 |
8.0 |
8.0 |
|
|
0.2%淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
0.20 mol·L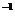 KNO3溶液 KNO3溶液 |
0 |
0 |
0 |
10.0 |
c |
|
0.20 mol·L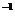 (NH4)2SO4 溶液 (NH4)2SO4 溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
20℃时,反应时间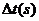 |
32 |
67 |
130 |
66 |
135 |
|
|
为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的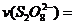 mol·(L·s)
mol·(L·s)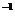 。
。
(4)根据上表数据分析,可以得到的结论有(写出一条即可) 。
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:
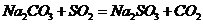

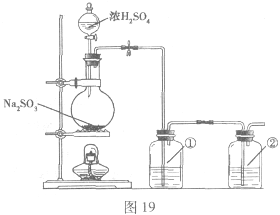
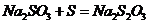
该小组根据上述原理设计如图19所示装置制备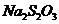 。
。
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是① ;② 。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的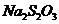 稀溶液中得到
稀溶液中得到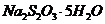 晶体的主要操作包括: 。
晶体的主要操作包括: 。


27.(14分)
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0-6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置如图18所示:
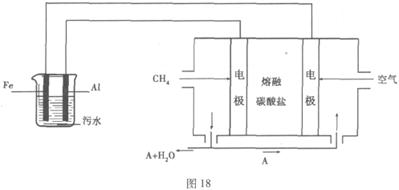 (1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.N2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是① ;
②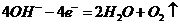 。
。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
已知负极的电极反应是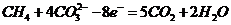 。
。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
26.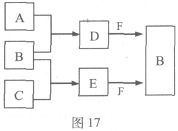 (12分)
(12分)
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图17 (反应条件和部分产物略去)。试回答:
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。
(已知甲醇的燃烧热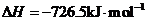 ,氢气的燃烧热
,氢气的燃烧热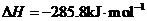 )
)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com