
25.(14分)已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物。

回答下列问题: (1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解溶液C的方法制备该单质,制备反应的化学方程式是 。 (2)①甲的化学式是 ,乙的化学式可能是 (写一种即可) ②若将溶液A与溶液B混合,产生白色沉淀,则该反应的离子方程式是 。
若W2和Z-具有相同电子层结构,则乙的电子式是 。
(3)Y单质可用来制造Y-空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。 ①若以溶液C为电解质溶液时,正极的反应式为 。
②若以氢氧化钾溶液为电解质溶液时,电池的总反应式为 。
O2 O2 O2 H2O
NH3 NO 吸收塔
某课外小组模拟上述部分过程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)
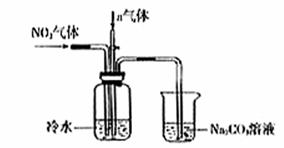 (1)工业上用氨气制取NO的化学方程式是
。
(1)工业上用氨气制取NO的化学方程式是
。
(2)连接好装置后,首先进行的操作是 。
(3)通入a气体的目的是 .
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生
反应的化学方程式是 2NO2+Na2CO3=====NaNO2+ +
(5)已知:温度低于21.15°C时,NO2几乎全部转变为
N2O2。工业上可用N2O4与水反应来提高硝酸产率。N2O4与
a气体在冷水中生成硝酸的化学方程式是 。
 (6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K=
。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为
。
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K=
。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为
。
12.下列叙述正确的是 ( )
①3Li+中含有的中子数与电子数之比为2:1 ②在C2H6分子中极性共价键与非极性共价键数之比为3:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1
A.①② B.②③ C.①③ D.③④
11.室温下,下列关于pH均为9、体积均为10m的NaOH溶液和CH3COONa溶液比较的说法,正确的是( )
A.两种溶液中的c(Na+)相等 B.分别加热到相同温度时,CH3COONa溶液的pH小
C.分别加水稀释到100mL时,两种溶液的pH依然相等D.两溶液中由水电离出的c(OH-)之比为10-9/10-5
10.右表是元素周期表的一部分。X、Y、Z、W均为短周期元素,X、W的质子数之和为23。下列说法正确的是 ( )
|
C.最高价氧化物对应水化物的酸性:W>Z
D.Z的氧化物不能溶于Y的氢化物的水溶液
8.下列各组离子一定能大量共存的是 ( )
A.在含有0.1mol/LCa2+的溶液中:Na+、K+、ClO-、Cl- B.在pH=12的溶液中:NH 、Na+、SO
、Na+、SO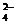 、Cl-
、Cl-
C.在c(H+)=0.1mol/L的溶液中:K+、I-、Cl-、NO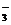 D.在澄清透明的无色溶液中:Na+、Cu2+、Cr2O
D.在澄清透明的无色溶液中:Na+、Cu2+、Cr2O 、NO
、NO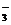
 9.下列对三种有机物的叙述不正确的是(-SH的性质类似于-OH) ( )
9.下列对三种有机物的叙述不正确的是(-SH的性质类似于-OH) ( )
A.三种有机物都能发生醋化反应
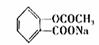 B.青霉氨基酸不能与盐酸反应,但能与NaOH反应
B.青霉氨基酸不能与盐酸反应,但能与NaOH反应
C.麻黄碱的分子式为C10H15ON,苯环的一氯代物有3种
D.阿司匹林能与适量NaOH反应生成可溶性阿司匹林( )
7.下列分离方法不合理的是 ( )
A.从石油中得到汽油,可用蒸馏的方法 B.提取溴水中的溴,可用加入乙醇萃取的方法
C.只含有泥沙的粗盐,可通过溶解、过滤、结晶的方法提纯
D.除FeCl2溶液中的少量FeCl3,可用加入足量铁悄过滤的方法
6.下列说法不正确的是 ( )
A.食盐既可作调味剂,也可作防腐剂 B.维生素C具有还原性,可用作食品抗氧化剂
C.向含有Hg2+的废水中加入Na2S3使Hg2+转化成HgS沉淀除去
D.淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应
2010.4
可能用到的相对原子质量:H 1 C 12 O 16 Fe 56
28.(16分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
 N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
 若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
。
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
。
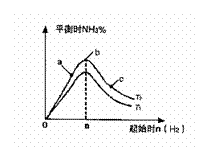
 (2)某科研小组研究:在其他条件不变的情况下,改变起始物氧气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氧气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
实验结果如图所示:
(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 (填字母)。
③在起始体系中加入N2的物质的量为 mol时,反应后氨的百分含量最大。若容器容积为H,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:
 2N2O3 4NO2(g)
△H>0下表为反应在T1温度下的部分实验数据
2N2O3 4NO2(g)
△H>0下表为反应在T1温度下的部分实验数据
|
Vs |
0 |
500 |
1000 |
|
c(N2O3)/mol·L-1 |
5.00 |
3.52 |
2.48 |
 ②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图所示,其中Y为CO2。
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图所示,其中Y为CO2。
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O3的电极反应式为 。
26.(14分)A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和衡稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氯化物DA,熔点为800℃DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是 (标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为
。
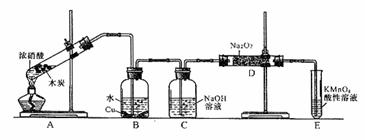 27.(12分)某化学兴趣小组以碳和浓硝酸为起始原料,想利用一氯化氮与过氧化钠反应制备亚硝酸钠。设计装置如下:(忽略装置中空气的影响)
27.(12分)某化学兴趣小组以碳和浓硝酸为起始原料,想利用一氯化氮与过氧化钠反应制备亚硝酸钠。设计装置如下:(忽略装置中空气的影响)
请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是 。
(2)猜测B中可以观察的主要现象是
。C瓶出来的气体是 。
(3)已知:①室温下存在反应3HNO2=HNO3+2NO↑+H2;②在酸性溶液中,NO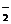 可将MnO
可将MnO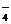 还原为Mn2+且无气体生成。写出检验D中产物是亚硝酸钠的方法:
还原为Mn2+且无气体生成。写出检验D中产物是亚硝酸钠的方法:
。
(4)E装置的作用是 。
(5)同学们经过讨论认为上述装置仍有缺陷,为避免D管中生成NaOH,你认为应该进行的改进是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com