
5. 1930年美国天文学家汤博发现冥王星,当时错估了冥王星的质量,以为冥王星比地球还大,所以命名为大行星.然而,经过近30年的进一步观测,发现它的直径只有2300公里,比月球还要小.2006年8月24日晚在布拉格召开的国际天文学联合会(IAU)第26届大会上,来自各国天文界权威代表投票通过联合会决议,今后原来九大行星中的冥王星将不再位于“行星”之列,而属于矮行星,并提出了行星的新定义.行星新定义的两个关键:一是行星必须是围绕恒星运转的天体;二是行星的质量必须足够大,它自身的重力必须和表面力平衡使其形状呈圆球.一般来说,行星直径必须在800公里以上,质量必须在50亿亿吨以上.假如冥王星的轨道是一个圆形,则由以下几个条件能估测出其质量的是(其中万有引力常量为G)( )
A.冥王星围绕太阳运转的周期和轨道半径
B.冥王星围绕太阳运转的线速度和轨道半径
C.冥王星一个的卫星查龙(charon)围绕冥王星在圆形轨道上转动的线速度和轨道半径
D.冥王星一个的卫星查龙(charon)围绕冥王星在圆形轨道上转动的周期和轨道半径
4. 下列有关热现象的叙述中正确的是( )
A.温度升高,物体内所有分子运动的速度大小都变大
B.凡是不违背能量守恒定律的实验构想,都是能够实现的
C.分子力随分子间距离的增大而减小,随分子间距离的减小而增大
D.温度升高,物体的内能不一定增大
3. 如图所示,电路与一绝热密闭气缸相连,Ra为电阻丝,电源有内阻,气缸内有一定质量的理想气体,电键S闭合,现将变阻器的滑动片向下移动的过程中,下列说法正确的是( )
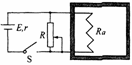 A.气缸内气体压强减小
A.气缸内气体压强减小
B.气体分子平均动能减小
C.气缸内气体的内能增大
D.气体分子单位时间内对器壁单位面积的撞击次数减少
2. 从四川省核电站发展论坛上传出消息:四川首家核电站项目顺利通过初步科研评审.该项目建成后,对四川乃至中国西部地区GDP增长和一、二、三产业的拉动将起到巨大作用.关于核电站获取核能的基本核反应方程可能是( )
A.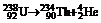 B.
B.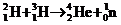
C.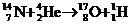 D.
D.
1. 下列说法中正确的是 ( )
A.玛丽·居里首先提出了原子的核式结构学说
B.卢瑟福在α粒子散射实验中发现了电子
C.查德威克在原子核人工转变的实验中发现了中子
D.麦克斯韦为了解释光电效应的实验规律提出了光子说
30.(14分)下图中A、B、C、D、E都是链状有机化合物。A分子中只含氯原子一种官能团,B物质能发生银镜反应。
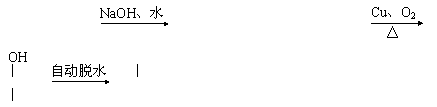 已知:①CH3CH2Cl
CH3CH2OH ②R-CH2OH R-CHO
已知:①CH3CH2Cl
CH3CH2OH ②R-CH2OH R-CHO
式量M1 式量M1-18.5 式量M2 式量M2-2
 ③-C-OH -C=O+H2O
③-C-OH -C=O+H2O
请回答下列问题:
⑴A的分子式为_______________。
⑵B分子中含有的官能团的名称是:___________________________。
⑶指出反应类型:B→C_______________;D→E______________。
⑷写出D→E的化学方程式(有机物用结构简式表示)________________________________。
⑸写出符合下列条件的B的同分异构体的结构简式_________________________________
_______________________________。
①水解产物之一为甲醇;②与金属钠反应放出氢气。
唐山市2009~2010学年度高三年级第二次模拟考试
29.(17分)某课题研究小组,探究镁粉与铝粉组成的混合物中铝元素的含量,甲同学利用A、B装置进行实验探究,供选药品有:①混合物样品;②浓硫酸;③稀硫酸;④氢氧化钠溶液。


⑴甲同学实验前必须进行的实验操作是____________,方法是________________________
____________________________________________________________________________
_________________________。
⑵该同学用托盘天平称取0.3g混合物样品,置于A中,从分液漏斗中滴加足量的稀硫酸,当无气泡放出时测得气体体积(折合为标准状况)为336mL,该同学测得样品中铝的质量分数是___________。
⑶该同学在最后读数时应注意的问题是____________(填写字母)
A.将烧瓶中的气体赶到量气管中 B.等冷却到室温后再读数
C.调整a装置与b装置液面相平 D.视线与液面最低点相平
⑷乙同学认为:即使各项操作均正确,甲同学所测得的样品中铝的质量百分含量一定会____________(填“偏低”、“偏高”或“无法确定”)。
⑸经思考,乙同学决定用C装置代替甲同学方案中的A装置进行实验,这样改进的优点是:①__________________________________;②____________________________________。
⑹丙同学认为用供选药品中的另一种代替稀硫酸进行实验,会使计算更方便,请你用离子方程式表示丙同学的实验原理_________________________________。
28.(15分)原子序数依次增大的五种短周期元素X、Y、Z、Q、R,已知X与Q同主族,Y、Z原子序数之比为3:4,Z的最外层电子数是Q的最外层电子数的6倍,R为同周期中原子半径最小的元素(稀有气体元素除外),X与R形成的化合物常温下为气态。
⑴表示Y元素中质子数与中子数相等的同位素符号是_____________。
⑵Q与Z形成的原子个数比为1:1的化合物的电子式是__________。
⑶A+B→C+D+H2O为中学化学常见的反应形式,A、B、C、D均为由上述五种元素组成的单质或化合物。
①如A为NaOH、B为CO2时,可写成
aNaOH+b CO2=cNa2CO3+dNaHCO3+nH2O,a与b的物质的量之比应满足的关系是_______。现向100mL、3mol/L的NaOH溶液中缓慢通入标准状况下4.48L的CO2气体,用1个化学方程式表示以上反应_____________________________________________(化学计量数为最简整数),此时溶液中各种离子物质的量浓度由高到低的排列顺序是__________________。
②请任写一个符合A+B→C+D+H2O形式的氧化还原反应方程式,其中C、D均为盐________
____________________________。
27. (14分)已知二元酸H2A在水中存在以下电离:H2A=H++HA-,HA- H++A2-。试回答下列问题:
(14分)已知二元酸H2A在水中存在以下电离:H2A=H++HA-,HA- H++A2-。试回答下列问题:
⑴NaHA溶液呈________(填“酸”、“碱”或“中”)性,理由是___________________。
⑵某温度下,向10mL、0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液VmL至中性,此时溶液中以下关系一定正确的是_________(填写字母)。
A.溶液pH=7 B.水的离子积Kw=[c(OH-)]2 C. V=10 D. c(K+) <c(Na+)
 ⑶已知难溶物CaA在水中存在溶解平衡:CaA(s) Ca2+(aq)+
A2-(aq );ΔH>0。一定温度下CaA饱和溶液中c (Ca2+) ·c (A2-)为常数,记作Ksp=c (Ca2+) ·c (A2-),Ksp只与温度有关。①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
⑶已知难溶物CaA在水中存在溶解平衡:CaA(s) Ca2+(aq)+
A2-(aq );ΔH>0。一定温度下CaA饱和溶液中c (Ca2+) ·c (A2-)为常数,记作Ksp=c (Ca2+) ·c (A2-),Ksp只与温度有关。①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②向浊液中通入HCl气体,c (Ca2+) ____________,原因是_____________________________。
⑷测得25℃时,CaA的Ksp为2.0×10-11。常温下将10gCaA固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c (Ca2+)=0.1mol/L,则溶液中c (A2-)=_________。
13. 复方蒿甲醚是由中国首先发现的可用于治疗疟疾的药物,目前在国际上获得广泛认可。其主要成分是青蒿素,青蒿素的结构简式如图所示。有关青蒿素的说法不正确的是
复方蒿甲醚是由中国首先发现的可用于治疗疟疾的药物,目前在国际上获得广泛认可。其主要成分是青蒿素,青蒿素的结构简式如图所示。有关青蒿素的说法不正确的是
A.青蒿素分子式为C15H22O5
B.在一定条件下1mol青蒿素能与含1molNaOH的溶液完全反应
C.青蒿素分子中含有过氧键,一定条件下有氧化性
D.青蒿素易溶于水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com