
29.(14分)现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径 (10-10m) |
0.74 |
1.02 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最 低化合价 |
|
+6 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
–2 |
–2 |
|
–3 |
–1 |
|
–3 |
|
回答下列问题:
(1)元素③在周期表中位置是 ; 元素④与元素⑦相比较,气态氢化物较稳定的是 (填化学式);
(2)元素①是 (写元素符号),元素⑥是 (写元素符号),二者按照原子个数比为1∶1形成的化合物与水反应的化学方程式为 ;
(3)元素⑤与元素②的非金属性强弱顺序为 (写元素符号),元素⑤的单质加入到元素②的氢化物的水溶液中,反应的化学方程式为 ;
(4)用电子式表示元素①氢化物的形成过程 ;写出元素⑦氢化物的电子式 ;写出实验室制元素⑤单质的化学反应方程式 。
28.(7分)(1)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应式为______,负极的电极反应式为___________,原电池的总反应是_____________;当有6.5g锌溶解时,则在标准状况下,放出的氢气的体积为 ,转移的电子数为 摩尔,溶液的酸性________(填“增强”或“减弱”)。
(2)选用下列试剂和仪器设计一个原电池。画出装置图。标明原电池的正极、负极、电解质溶液,并写出正极、负极的电极反应。
试剂:铜片、铁片、银片、镁条、硫酸铜溶液、硝酸银溶液。
仪器:烧杯、导线、铁夹(若还需其它仪器可自己补充)
27.(2分)下列反应中,属于放热反应的是_____,属于吸热反应的是________。
A.锌粒与稀H2SO4反应制取H2 B.Ba(OH)2·8H2O与NH4Cl反应
C.氢气在氧气中燃烧生成水 D.高温煅烧石灰石使其分解
E.氢气还原氧化铜 F.葡萄糖在人体内氧化分解
(请将试卷二的正确答案填写在答题纸中,只交答题纸)
26.(4分)下列各题中有关物质的比较,请用“>”、“<”、“=”填空:
(1)酸性:H3PO4 H2SO4 ,碱性:KOH Mg(OH)2;
(2)氧化性:Cl2 S,还原性:Clˉ Brˉ;
(3)稳定性:CH4 HF;
(4)微粒半径:Si Na;Fˉ Na+
(5)电子数目:H2O CH4
25.下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是
|
B.C为VA族元素
C.三种元素都为非金属元素
D.C是化学性质最活泼的非金属
24.100 mL 6 mol·L-1 H2SO4 跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
A.碳酸钠固体 B.水 C.硫酸钾固体 D.醋酸钠固体
23.一定温度下反应N2(g)+3H2(g) 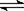 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A.N2、H2和NH3的物质的量浓度不再改变
B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.N2与H2的物质的量之和是NH3的物质的量2倍
D.单位时间里每增加1molN2,同时减少2molNH3
22.将锌片和铜片用导线连接后放入稀硫酸溶液中发生原电池反应,下列叙述正确的是
A.负极附近的SO42- 浓度逐渐增大 B.正极有O2逸出
C.电子通过导线由铜片流向锌片 D.铜片上有H2逸出
21.砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是
A.砹易溶于某些有机溶剂 B.砹化氢很稳定不易分解
C.砹是有色气体 D.砹化银不溶于水或稀HNO3
20.已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减少,B与E同主族,则下列推断不正确的是
A.D位于第二周期 B.A、B、E一定位于不同周期
C.A、D可能属同一族 D.C和D的单质可能化合形成离子化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com