
1.函数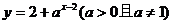 的图像一定经过点
(
)
的图像一定经过点
(
)
A.(2,3) B.(2,2) C.(3,2) D.(3,3)
28.(8分) 如右图所示,一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g) + 2H2(g)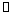 CH3OH(g)
CH3OH(g)
(1)上述可逆反应正反应为___________反应(填“放热”或“吸热”)。
 (2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2) =_______________________(用nB、tB表示)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2) =_______________________(用nB、tB表示)。
(3)对处于E点的体系,改变外界条件使平衡向正反应方向移动时,下列有关该体系的说法正确的是______________________(填字母)。
A.H2的转化率一定增大 B.v正一定增大,v逆一定减小
C.CH3OH的质量分数一定增加 D.v逆一定小于v正
(4) 在恒温横容条件下,充入2molCO和1molH2 达平衡时,CH3OH的体积分数为ω,CO的转化率为α。若相同条件下,向上述容器中分别充入amolCO 、bmol H2、cmol CH3OH(g),要使达到平衡时容器内CH3OH的体积分数仍为ω,则a、b、c应满足的关系为 、 。(用a和c、 b和c的关系表示)
若平衡时CO的转化率α=20%,则欲使起始时反应表现为向逆反应方向进行,则C的取值范围是 。
25.(10分) 有3种可溶性离子化合物A、B、C,共含六种离子,它们分别由阳离子NH4+、Na+、Cu2+ 和阴离子OH-、S2-、SO42-两两结合而成,取质量相等的A、B、C分别溶解于水,配成等体积的溶液,这3种溶液物质的量浓度大小的顺序是B<A<C,根据题意回答下列问题:
(1) 推断出A是____________,B是_____________.(填化学式)
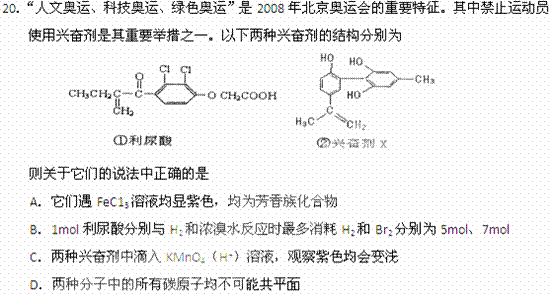
(2) 室温时B溶液的pH__________7(填“>”、“=”或“<”),原因是__________________
_________________________________________________(用离子方程式表示).
(3) 向A溶液中加入适量的固体B,两者恰好完全反应,请写出发生反应的离子方程式:___________________________________;若反应前后溶液的体积相等,则原A溶液中c (NH4+ ) _______反应后所得溶液中c (NH4+ )(填“>”、“=”或“<”).
(4)向A溶液中加入等物质的量的过氧化钠固体并加热,写出反应的离子方程式:
。
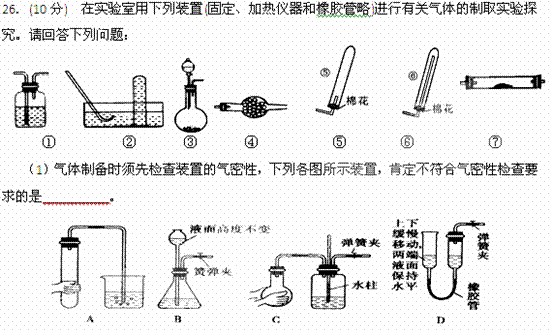
(2)若用装置③制取并收集干燥的NH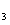 ,烧瓶内装的试剂是_____________,分液漏斗中装的试剂是_________________,收集装置应选择________________(填装置序号)。证明氨气已收集满的操作是___________________________________________。
,烧瓶内装的试剂是_____________,分液漏斗中装的试剂是_________________,收集装置应选择________________(填装置序号)。证明氨气已收集满的操作是___________________________________________。
(3)将氨气通过灼热的氧化铜粉末,得到氮气和铜。要制取并收集纯净的氮气(可含有少量的水),应使用上述仪器中的(填装置序号,并按气流方向从左向右列出): ③→____________________________________。此时①中应盛放 ,
 ⑦中发生反应的化学方程式是:
。
⑦中发生反应的化学方程式是:
。
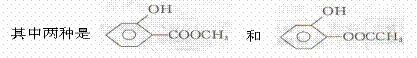
含有一COO一结构基团要求的D的同分异构体有4种。
则另外两种的结构简式为 、 ;

。
24.(10分) 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
|
序号 |
HA的浓度/mol·L-1 |
NaOH的浓度/mol·L-1 |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
(1).不考虑其他组的实验结果,仅从甲组情况分析,如何用a的大小来说明HA是强酸还是弱酸 。
(2).不考虑其他组的实验结果,仅从乙组情况分析:
① c是否一定是等于0.2_________________(填“是”或“否”);
② 混合溶液中离子浓度c(A-)与c(Na+)的大小关系是______________________
A.前者大 B.后者大 C.二者相等 D.无法判断
(3).从丙组实验结果分析:
③ HA是_________________酸(填“强”或“弱”);
④ 该混合溶液中离子浓度由大到小的关系是
__________________________________________________________________
(4).写出丁组实验所得溶液中下列算式的精确结果(不能做近似计算):
⑤ c(OH-) - c(HA) = ______________mol·L-1
23.(10分)A,B,C,D,E,F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其 中B与C为同一周期,D,E,F为同一周期,A与D,C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)F元素在周期表中的位置为 ,D的离子结构简图为 ,
(2)由A,C两元素可以组成X,Y两种化合物,X在一定条件下可以分解成Y,X的电子式 为____,其分子属于_____(填“极性”、“非极性”)分子。
(3)E是非金属元素,其单质在电子工业中有重要应用,请写出工业生产单质E(粗产品)的化学反应方程式: 。
(4)一定条件下,A的单质气体与B的单质气体充分反应生成6.8g W气体(已知n(A):n
(B)=3:1),可放出18. 44 W热量,则该反应的热化学方程式 。
(5 )A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则M极的电极 反应式为 。
22.将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用
l mol·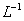 的盐酸滴定,至沉淀质量最大时,消耗盐酸40 mL,原合金中钠的质量为
的盐酸滴定,至沉淀质量最大时,消耗盐酸40 mL,原合金中钠的质量为
A.0.46 g B.0.69 g C.0.92 g D.0.23 g.
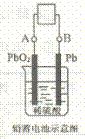
21.电瓶车所用电池一般为铅蓄电池,是一种典型的可充电电池,如右图所示。
 电池总反应式为:
电池总反应式为:
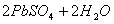 ,
,
则下列说法正确的是
A.放电时:电流方向由B到A
B.放电时;正极反应是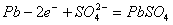
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是
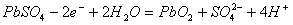
19.下列现象不能用勒夏特列原理解释的是
A.向血红色的Fe(SCN)3溶液中加入少量KSCN固体,溶液颜色加深
B.合成氨工业中选择较大压强和较高温度以提高NH3的产率
C.向水中加入酸或碱均会抑制水的电离
D.配制FeCl3溶液时,先将其溶于浓盐酸中再加水稀释
18.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是:①向饱和
碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ③
向AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③
C.①④ D.②③
17.对于密闭容器中的可逆反应:mX (g) + nY(s)  pZ (g);ΔH<0,达化学平衡后,改变条件,下列表述不正确的是 ( )
pZ (g);ΔH<0,达化学平衡后,改变条件,下列表述不正确的是 ( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动 
C.增加X或Y的物质的量,化学平衡一定发生移动

D.其它条件不变,升高温度,化学平衡一定发生移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com