
7.已知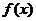 在
在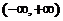 上的偶函数,且在
上的偶函数,且在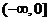 上是增函数,设
上是增函数,设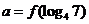 ,
,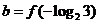 ,
,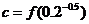 ,则
,则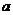 、
、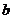 、
、 的大小关系是
的大小关系是
A、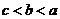 B、
B、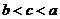 C、
C、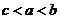 D、
D、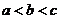
6.已知双曲线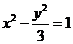 的焦点
的焦点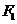 、
、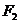 ,点
,点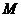 在双曲线上且
在双曲线上且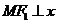 轴,则
轴,则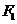 到直线
到直线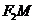 的距离为
的距离为
A、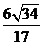 B、
B、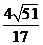 C、
C、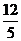 D、
D、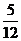
5.设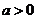 ,
,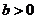 ,则下列不等式中不恒成立的是
,则下列不等式中不恒成立的是
A、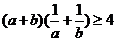 B、
B、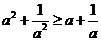
C、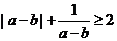 D、
D、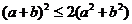
4. 已知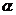 、
、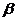 是平面,
是平面,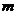 、
、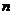 是直线,给出下列命题
是直线,给出下列命题
①若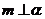 ,
,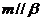 ,则
,则
②如果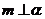 ,
,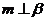 ,则
,则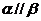
③如果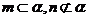 ,
,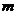 ,
,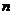 是异面直线,那么
是异面直线,那么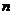 不与
不与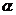 相交。
相交。
④若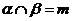 ,
,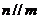 且
且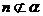 ,
,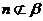 ,则
,则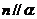 且
且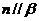 。
。
其中真命题的个数是
A、1 B、2 C、3 D、4
3.已知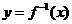 是函数
是函数 的反函数,则
的反函数,则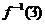 的值是
的值是
A、8 B、3 C、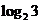 D、2
D、2
2.设向量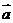 与
与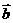 的夹角为
的夹角为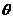 且
且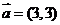 ,
,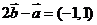 ,则
,则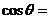
A、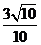 B、
B、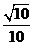 C、
C、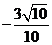 D、
D、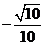
1.已知集合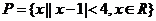 ,
,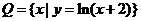 ,则
,则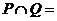
A、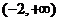 B、
B、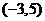 C、
C、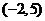 D、
D、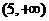
5. (9分)
(9分)
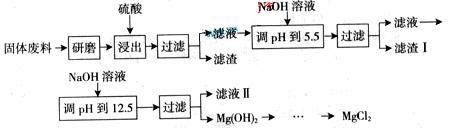
 某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
PH |
3.2 |
5.2 |
12.4 |
 部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
 (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 、___________(要求写出两条)。
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 、___________(要求写出两条)。
 (2)滤渣I的主要成分有
。
(2)滤渣I的主要成分有
。
 (3)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
(3)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
 MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
 已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:

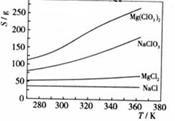
 ①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
。
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
。
 ②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
________。除去产品中该杂质的方法是:
__________。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
________。除去产品中该杂质的方法是:
__________。
3、
 (10分)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(10分)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
 (1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 。
 (2)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
(2)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
 ①甲醇的沸点比甲醛的高,其主要原因是
;
①甲醇的沸点比甲醛的高,其主要原因是
;
甲醛分子中碳原子轨道的杂化类型为 。
 ②甲醛分子的空间构型是
;1mol甲醛分子中σ键的数目为 。
②甲醛分子的空间构型是
;1mol甲醛分子中σ键的数目为 。
 4、(10分)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
4、(10分)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
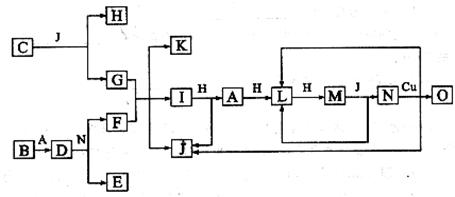
请回答下列问题:
(1) 组成B单质的元素位于周期表第______________周期,第_______________族。化合物C的电子式为__________________________________。
(2) J的沸点比硒化氢(H2Se)的沸点高,其原因是_________________。
(3) 写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4) 写出D与足量的N反应生成E和F的化学方程式:_____________________。
2. (12分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(12分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
 (4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
 a.MnO2 b.NaCl c.Na2SO3 d.KMnO4
a.MnO2 b.NaCl c.Na2SO3 d.KMnO4
 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

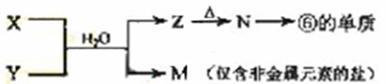
 X溶液与Y溶液反应的离子方程式为_____________________,
X溶液与Y溶液反应的离子方程式为_____________________,
 N→⑥的单质的化学方程式为________________。
N→⑥的单质的化学方程式为________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com