
5、 “函数f(x)在点x=x0处有定义”是“函数在点x=x0处连续”的 A、充分不必要条件 B、必要不充分条件 C、充要条件 D、既不充分也不必要条件
4、 已知等差数列{an}的前n项和为Sn(n∈N*),且S3=-3,S7=7,那么公差d= A、1 B、2 C、3 D、4
3、 某学校有教职工100人,其中教师80人,职员20人,现从中选取10人组成一个考察团外出学习考察,则这10人中恰好有8名教师的不同选法种数是 A、C802C208 B、A802A208 C、A808A202 D、C808C202
2、 设集合A={x|-1<x≤2,x∈N},集合B={2,3},则A∪B等于 A、{1,2,3} B、{0,1,2,3} C、{2} D、{-1,0,1,2,3}
1、 函数f(x)=sinx+cosx的最小正周期为 A、 B、 C、π D、2π
25. U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴.V的单质分子的结构式为_______________;XW的电子式为____________;
Z元素在周期表中的位置是_____________。
⑵.U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明____________________________________________________。
⑷.YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
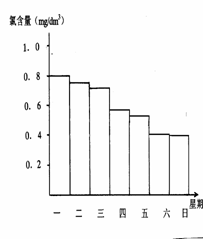
0.5mg/L至1.0mg/L之间时,效果最好。右图是该小
组测定的每天19∶00时泳池中水的氯含量,有哪几
天使用泳池不安全 ;
(3)你认为哪几天的天气炎热、阳光强烈 ,说出一种理由是
;
(4)在对泳池水中通入氯气消毒时,当发生氯气泄漏时,应立即关闭氯气罐,还应采取下列自救方法 。(选填序号)
A、用湿润的毛巾捂住口鼻跑向低处
B、用浸湿小苏打或肥皂水的毛巾捂住口鼻跑向高处
C、用浸湿浓氨水的毛巾捂住口鼻匍匐跑至安全处
D、用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处
(5)小型泳池通常使用漂白液(NaClO溶液)而非氯气来消毒池水,试举出使
用漂白液而非氯气的一项理由 ;
(6)请再写出你能知道的能用于饮用水消毒的消毒剂 .(至少写三种,否则不得分) 请在你书写的药品中选择一种你认为最好的带上飞机,并说明它的原因。选择 原因是 。
(7)较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。该校甲、乙两化学研究性学习小组均用200 mL 12 mol / L盐酸与17.4 g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀氢氧化钠溶液吸收残余的氯气。分析实验结果发现:① 甲、乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值,② 甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。试回答下列问题:
a. 上述实验中理论上最多可制得Ca(ClO)2 克?
b. 实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。(至少说出一种理由,写出一个方程式)
24、某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到
 氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
(1)氯气可以用于漂白、消毒的原因是因为能与水
作用形成具有 性的次氯酸,相关反应的离子方程式为 ;
(2)在调查某室外游泳池夏季池水消毒情况时,小
组成员了解到,该游泳池每周一上午8∶00换水,然
后通入氯气消毒,通常游泳池水的含氯量控制在
23.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子八种微粒(离子或分子)。请回答:
⑴A元素是 、B元素是 、C元素是 (用元素符号表示)。
⑵D是由两种元素组成的双原子分子,其分子式是 。
⑶E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。
⑷F是由两种元素组成的三原子分子,其分子式是 ,电子式是 。
⑸G分子中含有4个原子,其分子式是 。
⑹H分子中含有8个原子,其分子式是 。
22.诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。他的方法不仅被用于学术研究而且被用于化学工业研发。下面选项与物质的表面特性无关的是( )
A.CO在铂表面被氧化生成CO2,铂起催化作用 B、合成氨用铁粉做催化剂
C.汽车尾气中NOx在铂表面发生反应的产物是N2 D、用明矾来净水
E.CO在铂表面可能和O2、NOx反应 F.NOx、CO均能与人体中的血红蛋白结合
G、用还原铁粉和石棉绒混合物与水蒸气制得Fe3O4和H2
H、配制FeCl3 溶液时将FeCl3固体溶于浓盐酸中再加水稀释
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com