
24.(6分)
已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200mL混合溶液中含FeI2、FeBr2各0.20mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其他反应)
(1)若氯水中有0.3molCl2被还原,则所得溶液中含有的阴离子主要有____________,剩余Fe2+的物质的量为_______________mol。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为___________mol。
23. (10分)
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)Y的原子结构示意图是 、Z在周期表中的位置是
(2)X、Y、Z原子半径由大到小的顺序为 (用元素符号表示)
(3)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是
(4)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是 和
(5)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是
22.(10分)
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
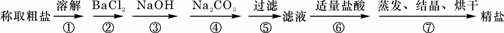
(1)能否将BaCl2与Na2CO3的加入顺序互换; (填“能”或“不能”);
理由是
 (2)第⑥步中,相关的离子方程式是
(2)第⑥步中,相关的离子方程式是
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
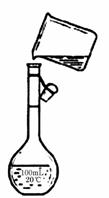
(4)为检验精盐纯度,需配制250 mL.0.2 mol/L NaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是
21.(8分)
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)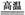 CO(g)+H2(g);
CO(g)+H2(g);
②C(s)、 CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)  CO2(g);ΔH=-393.5 kJ·mol-1
CO2(g);ΔH=-393.5 kJ·mol-1
H2(g)+ 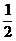 O2(g)
O2(g)
 H2O(g);ΔH=-242.0 kJ·mol-1
H2O(g);ΔH=-242.0 kJ·mol-1
CO(g)+ 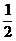 O2
O2 CO2(g);ΔH=-283.0 kJ·mol-1
CO2(g);ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:
__________________ 。

 (2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
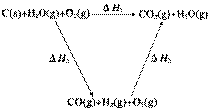
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是__________________(填“甲”或“乙”);判断的理由
是_______________________ 。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点_______________________ 。
20、离子反应为aMnO4 - + bI-+ H+→ Mn2++ cI2 + dIO3- + H2O;根据该离子方程式,下列说法不正确的是
A.氧化性MnO4 ->IO3-
B.若c=d=5,则该反应转移电子数为30e-
C. I2 和IO3-都是氧化产物
D. a、b、c、d之间的关系是:5a=2c +6d;b=2c+d
第Ⅱ卷(非选择题 共50分)
19.下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→ C(金刚石);ΔH = +1.9 kJ/ mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+ OH-(aq) == H2O(l);ΔH =-57.3 kJ/ mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ
D.在101 kPa、25℃ 时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g) + O2(g) == 2H2O(l);ΔH =-285.8 kJ/ mol
18.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
A.由mXa+与nYb-得,m+a=n-b
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
17.下列叙述正确的是( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其它周期均为18种元素
C.副族元素没有非金属元素
D.ⅠA族的所有的元素都是金属元素
16.在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO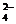 、Fe3+?
、Fe3+?
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO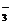 、Cl-
、Cl-
C.c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO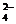 、Cl-、H+
、Cl-、H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com