
6. 下列实验操作合理的是
A.用25 mL滴定管进行滴定实验时,消耗某溶液体积为21.70 mL
B.在托盘天平的托盘上各垫一张洁净的纸片直接称量NaOH固体
C.用广泛pH试纸测得某溶液的pH为2.3
D.中和滴定实验中的锥形瓶使用前应该用待装液洗涤
5. 一定温度下的反应A(g)+3B(g) 2C(g),下列叙述不能表明它达到化学平衡的是
2C(g),下列叙述不能表明它达到化学平衡的是
A.C的生成速率与C的分解速率相等
B.混合气体的总物质的量不再变化
C.A、B、C的浓度不再变化
D.单位时间内生成a mol A,同时生成3a mol B
4.下列各组离子,在指定的环境中能大量共存的是
 A.25℃,pH=0的溶液中:Al3+、NH4+、NO3-、Fe2+
A.25℃,pH=0的溶液中:Al3+、NH4+、NO3-、Fe2+
 B.在中性溶液中:Al3+、K+、SO42-、HCO3-
B.在中性溶液中:Al3+、K+、SO42-、HCO3-
 C.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、NO3-
C.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、NO3-
 D.在酸性溶液中:Na+、K+、MnO4-、SO32-
D.在酸性溶液中:Na+、K+、MnO4-、SO32-
3. 下列变化过程中,△S<0的是
A.氯化钠溶于水 B.NH3(g)与HCl(g)反应生成NH4Cl(s)
C.干冰(CO2)的升华 D.CaCO3(s)分解为CaO(s)和CO2(g)
2. 符合下列条件的化学反应肯定是自发的是
A.△H<0,△S<0 B.△H<0,△S>0
C.△H>0,△S>0 D.△H>0,△S<0
1. 下列反应属于氧化还原反应,而且△H>0的是
A.灼热的炭与CO2反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.铝片与稀H2SO4反应 D.甲烷在O2中的燃烧反应
29.(16分)已知:①ROH+HBr(氢溴酸) RBr+H2O
RBr+H2O
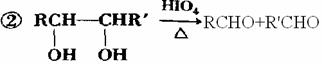
奶油中有一种化合物A(C4H8O2),A可用作香料。A中含有碳氧双键,与A相关的反应如下:
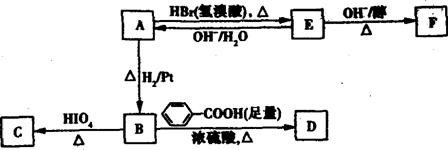
(1)写出与A分子式相同的所有酯的结构简式: 。
(2)写出反应类型:反应A→E ,反应E→F 。
(3)写出A、C、F的结构简式:A 、C 、F 。
(4)写出B→D反应的化学方程式: 。
(5)若在空气中长时间搅拌奶油,A可转化G,G蒸气对H2的相对密度为43,且G的一氯代物只有一种,写出G的结构简式: 。
27.(14分)反应①②是重要的化工反应,D、E、F、G、M为单质,D、E、G、H为气体,且只有E为有色气体,G是空气中主要成分之一,F、M是生活中常见的金属,K是白色沉淀,C的焰色反应为黄色,P是M和紫黑色固体单质化合的产物,P、J、L、M含有同种元素,其物质间转化关系如下,虚框内是需设计的内容,反应物只能用A-N中的物质。请回答下列问题:
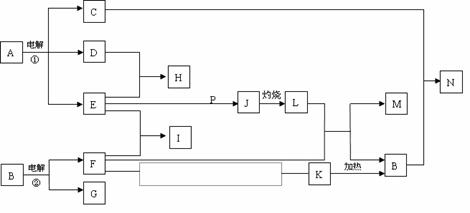
(1)用电子式表示H物质的形成过程
(2)电解池①中的阴极产物的名称
(3)足量的E与P溶液反应生成J,离子方程式为
(4)N溶液呈碱性,用离子方程式解释原因
(5)请模仿上述物质转化关系图设计F→K的最佳途径:(用A-N中的物质的化学式表示)

F → →K
按设计得到1molK,至少需要另加的试剂及其物质的量是
n( )= mol;n( )= mol。
|
Na2SO3(s) + H2SO4(85%)==Na2SO4 + H2O + SO2↑
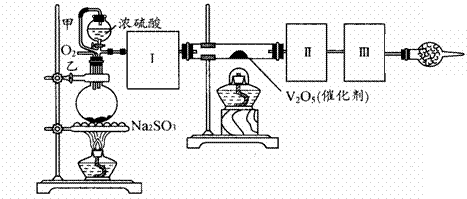
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A-E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是 _______ 、
_____ 、 _______ 。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是 。若用大火加热烧瓶时,SO2的转化率会 (填“升高”、“不变”或“降低”)
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因 ,验证方法
②原因 ,验证方法
③原因 ,验证方法
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
26.(15分)以下是元素周期表的一部分,根据图示回答下列问题:
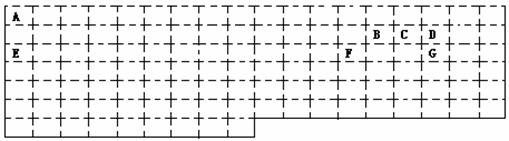
(1)请在表中用实线补全元素周期表的边界
(2)A、C形成的10电子阳离子的空间构型是________________;
写出工业上由GD2合成GD3 的化学方程式_________________________________;
(3)E在D2中燃烧生成的化合物X中阴阳离子的个数比为____________;X中的化学键类型是_____________________;晶体类型是_______________。
(4)2.00gB2A2完全燃烧生成BD2和液态A2D,放出99.6KJ热量,写出B2A2燃烧热的热化学反应方程式______________________________________________________;
(5)BD2的电子式为______________;向含E的最高价氧化物的水化物0.05 mol的水溶液中通入标况下BD2气体1.12L,其反应离子方程式是_____________________。
13.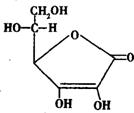 维生素C(Vitamin C,Ascorbic Acid)又叫L一抗坏血酸,是一种水溶性维生素。它是人体必需的一种维生素,人体若长期缺乏维生素C,易患坏血病。已知维生素C具有酸性和较强的还原性,加热或在溶液中易被氧化分解,在碱性条件下更易被氧化,维生素C的结构简式如图所示。下列有关维生素C的说法不正确的是( )
维生素C(Vitamin C,Ascorbic Acid)又叫L一抗坏血酸,是一种水溶性维生素。它是人体必需的一种维生素,人体若长期缺乏维生素C,易患坏血病。已知维生素C具有酸性和较强的还原性,加热或在溶液中易被氧化分解,在碱性条件下更易被氧化,维生素C的结构简式如图所示。下列有关维生素C的说法不正确的是( )
A.维生素C是一种羧酸,常温时其水溶液的pH<7
B.1 mol维生素C和足量钠反应最多可生成2 mol H2:
C.向KMnO4溶液中滴入维生素C溶液,可观察到溶液紫红色消失
D.一定条件下,维生素C既能和稀硫酸反应,又能和醋酸反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com