
1.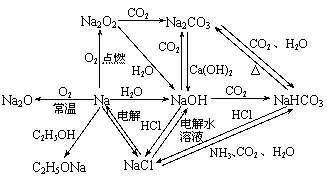 以Na为中心的转化关系图
以Na为中心的转化关系图
2.硅及其化合物的特殊性
⑴硅的还原性比碳强,而碳在高温下能从二氧化硅中还原出硅。
⑵非金属单质与强碱溶液反应一般不生成氢气,而硅与氢氧化钠等强碱溶液反应产生氢气。
⑶非金属单质一般不与非氧化性酸反应,而硅不但与氢氟酸反应,而且有氢气生成。
⑷酸性氧化物一般不与酸发生复分解反应,而二氧化硅却能与氢氟酸反应,生成四氟化硅和水。
⑸无机酸一般易溶于水,而硅酸和原硅酸却难溶于水。
⑹在水溶液中,碳酸的酸性比硅酸强,二氧化碳与硅酸钠反应生成碳酸钠和硅酸沉淀。在高温下碳酸钠与二氧化硅反应生成硅酸钠和二氧化碳,其原因是在高温条件下,生成的二氧化碳离开反应体系而使反应进行到底。
1.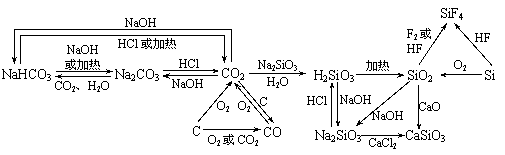 以CO2为中心的转化关系图
以CO2为中心的转化关系图
3.关于硝酸化学性质的几个问题
⑴硝酸的还原产物可以为:NO2、NO、N2O、N2、NH3、NH4+等,HNO3的浓度越低,还原产物的价态越低。
⑵试管壁上的Cu或Ag应用稀硝酸洗去:用稀硝酸比用浓硝酸的HNO3利用率高,且产生的污染物(NOx)少。
⑶在化学反应过程中,因量变积累,常常引起反应实质的变化,除硝酸外,硫酸、盐酸其浓溶液、稀溶液的性质不同,反应过程中浓度变化也往往引起反应实质的变化,解题应给予充分注意。
⑷浓硝酸久置变黄,工业盐酸为黄色(含Fe3+)、亚铁盐放置溶液变黄(Fe2+被氧化为Fe3+)、KI溶液久置变黄(I-被氧化为I2),其中亚铁盐溶液中要加铁粉保存且现配现用。
⑸硝酸越浓,其氧化性越强,被还原的程度越小。硝酸的氧化性强弱不是根据硝酸被还原的产物的化合价改变的大小来决定,而是得电子难易程度决定。
⑹在单质与硝酸反应的有关计算中,要注意单质是金属还是非金属,若为金属参加的反应硝酸分为两部分,一部分作氧化剂,另一部分起酸性生成硝酸盐,应先确定未被还原的硝酸,再由电子得失守恒求解。若为非金属单质与硝酸反应时,硝酸全部被还原。
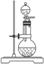
2.实验室快速制取氨气的方法是:
|
方法 |
化学方程(或原理) |
气体发生装置 |
|
加热浓氨水 |
NH3·H2O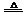 NH3↑+H2O NH3↑+H2O |
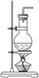 |
|
浓氨水+固体NaOH或生石灰 |
NaOH溶于水放热,促使氨水分解: NH3·H2O 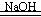 NH3↑+H2O NH3↑+H2ONH3·H2O+CaO=NH3↑+Ca(OH)2 |
 |
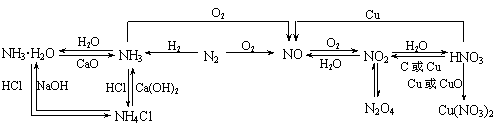
1.以NO为中心的转化关系图
2.溶液中SO42-的检验
⑴原理:利用Ba2++ SO42-=BaSO4↓ (白色),BaSO4具有不溶于盐酸、硝酸的特性。
⑵试剂:可溶性钡盐(BaCl2或Ba(NO3)2溶液)、盐酸或稀硝酸。
⑶检验的误区:
①只加可溶性钡盐,不酸化。误将CO32-、PO43-、SO32-、Ag+等干扰离子判成SO42-,此时上述离子同样会产生BaCO3、Ba3(PO4)2、BaSO3、AgCl的白色沉淀。
②误将Ag+、Pb2+判成SO42-。如向待测液中滴加BaCl2溶液,再加盐酸有白色沉淀便断定含SO42-。其错误是未注意溶液中不含SO42-而含Ag+或Pb2+也会有同样现象。
因为Ag++Cl-==AgCl↓(白色) Pb2++2Cl-==PbCl2↓(白色)
③误将SO32-判成SO42-。如向待测液中滴加用盐酸酸化的Ba(NO3)2溶液生成白色沉淀,便误以为有SO42-。该错误是未注意NO3-具有强氧化性,在酸性环境中发生反应:
Ba2++ SO32-==BaSO3↓(白色),3BaSO3+2H++2 NO3-==3BaSO4↓(白色)+2NO↑+H2O
再如向待测液中滴加用硝酸酸化的BaCl2溶液产生白色沉淀,便错误地认定一定含SO42-,也同样是落入干扰离子转化为SO42-从而生成BaSO4的陷阱中。
⑷检验的关键:既要注意试剂的选择,又要注意操作顺序的优化,方能排除干扰离子的误导,全面考虑,综合分析,正确推导。
1.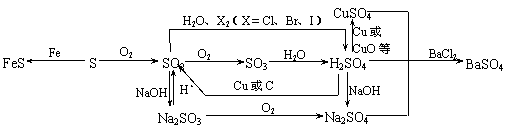 以SO2为中心的转化关系图
以SO2为中心的转化关系图
3.漂白原理的比较:
⑴氧化漂白。氯水、次氯酸盐、Na2O2和H2O2在一定条件下分解放出原子氧,原子氧(可表示为[O])的活性很强,有较强的氧化能力,能将许多有色物质氧化成无色物质,从而达到漂白的目的。被漂白的物质不变色,此类漂白剂能漂白酸碱指示剂。
⑵化合漂白。如SO2的漂白,其原理是SO2溶于水生成亚硫酸,亚硫酸与有色物质化合,形成不稳定的无色化合物,无色化合物在一定条件下(如加热)分解恢复原色。SO2不能漂白酸碱指示剂。
⑶吸附漂白。活性炭、硅藻土的漂白原理是由于有许多小孔隙,总表面积大,有较强的吸附作用,通过吸附溶液中的一些有色物质或有色离子或有色气体使之褪色,属于物理变化。
2.能与氯气反应的物质归类如下:
|
物质类别 |
非金属 单质 |
金属 单质 |
水 |
碱 |
非金属 氧化物 |
还原性 离子 |
有机物 |
|
|
代表物质 |
H2、P |
Na、Cu、Fe |
H2O |
NaOH、Ca(OH)2 |
SO2(水溶液中) |
Fe2+、SO32-、S2-、Br-、I- (水溶液中) |
烯烃、 炔烃 |
烷烃、 芳香烃 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com