
3.常能发生歧化反应和归中反应的元素有:Cl、Br、I、N、S、Fe、Cu等。
[思想方法]
[例1]今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4 mol·L-1的FeCl3溶液(其它用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变):
|
组别 |
① |
② |
③ |
④ |
|
V[FeCl3(aq)]/mL |
100 |
100 |
100 |
100 |
|
混合粉末质量/g |
6 |
13.2 |
24 |
36 |
|
反应后剩余固体质量/g |
0 |
1.28 |
12.8 |
24.8 |
下列结论正确的是
A.第①组反应后溶液中c(Fe3+) = 3.0 mol·L-1
B.第②组剩余固体全是铜
C.第④组反应后的滤液中c(Fe2+) = 6 mol·L-1
D.原混合粉末中n(Fe)∶n(Cu) = 3∶2
[分析]解答此题除了必须具备扎实的知识功底之外,其匠心还在于要求解题者必须具备:①破译复杂数据信息和选择适用信息的能力;②能透过现象抓本质的判断离子反应进行先后的能力;③在思维受阻时良好的心理承受能力。第①组数据只能说明固体混合物已全部溶解。第②组数据说明固体混合物反应后有剩余,则原FeCl3溶液已耗完,根据铁粉、铜粉与FeCl3溶液反应的先后顺序可判断溶液中的溶质有2种可能,一种只有FeCl2,另一种为FeCl2与CuCl2的混合物。对比第②组和第③组数据:固体粉末增加10.8 g,而反应后剩余固体质量增加11.52 g,两者质量不等,由此说明第②组反应后溶液中不可能只有FeCl2(否则无任何反应发生),而是FeCl2与CuCl2的混合物,同时可得1.28 g固体全为金属铜,选项B正确。设13.2 g固体粉末中含xmolFe,ymol铜,则共反应了铜(y-0.02)mol,
Fe+2FeCl3  3FeCl2(先) Cu + 2FeCl3
3FeCl2(先) Cu + 2FeCl3  CuCl2
+2FeCl2(后)
CuCl2
+2FeCl2(后)
x 2x y-0.02 2(y-0.02)
 56x+64y
56x+64y 13.2
13.2
2x+2(y-0.02) 0.4
0.4
联立解得x = 0.11,y = 0.11,则原混合粉末中n(Fe):n(Cu) = 1:1,选项D错。
同理可得原6 g混合粉末中含铁和铜各0.05 mol,
Fe+ 2FeCl3  3FeCl2(先) Cu + 2FeCl3
3FeCl2(先) Cu + 2FeCl3  CuCl2
+2FeCl2(后)
CuCl2
+2FeCl2(后)
2.由
1.由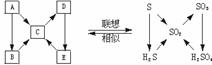 、
、
3.氢氧化亚铁的制备方法
因Fe(OH)2在空气中易氧化,4Fe(OH)2+O2+2H2O==4Fe(OH)3,故Fe(OH)2在水中稳定存在的寿命只有几秒钟,在实验室制取Fe(OH)2时,一定要用新制的Fe2+盐和先加热驱赶O2后的NaOH溶液,且滴管末端插入试管内的液面下,再滴加NaOH溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,以减少Fe(OH)2与O2接触。
关于Fe(OH)2制备的方法很多,核心问题两点,一是溶液中的溶解氧必须除去,二是反应过程必须与O2隔绝。
2.Fe2+与Fe3+的鉴别
⑴直接观察颜色:Fe2+的溶液呈浅绿色,Fe3+的溶液呈棕黄色。
⑵利用显色反应:
①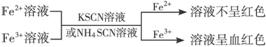 ,有关离子方程式:Fe3++SCN-==[Fe(SCN)]2+
,有关离子方程式:Fe3++SCN-==[Fe(SCN)]2+
②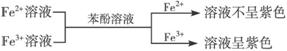
⑶利用铁化合物沉淀的颜色:
①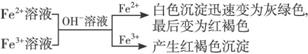
有关反应式:Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+2H2O+O2=4Fe(OH)3。Fe3++3OH-==Fe(OH)3↓。
②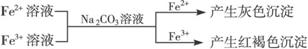
有关离子反应式:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
⑷利用Fe3+的氧化性:
①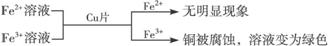 ,有关离子反应式:2Fe3++Cu==2Fe2++Cu2+
,有关离子反应式:2Fe3++Cu==2Fe2++Cu2+
②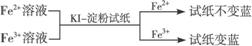 ,有关离子反应式:2Fe3++2I-==2Fe2++I2
,有关离子反应式:2Fe3++2I-==2Fe2++I2
③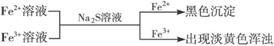 ,有关离子反应式:Fe2++S2-==FeS↓,Fe3++S2-=2Fe2++S↓
,有关离子反应式:Fe2++S2-==FeS↓,Fe3++S2-=2Fe2++S↓
⑸利用Fe2+的还原性:
①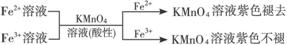 ,
,
有关离子反应式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
②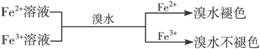 ,有关离子反应式:2Fe2++Br2==2Fe3++2Br-
,有关离子反应式:2Fe2++Br2==2Fe3++2Br-
注:以上方法以KSCN溶液鉴别最常用。
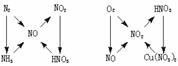
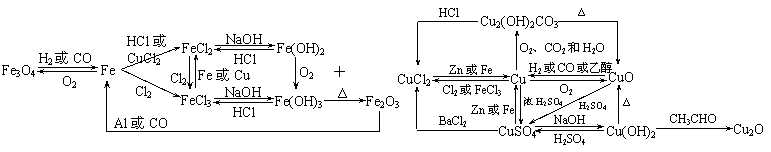
1.以铁、铜为中心的转化关系
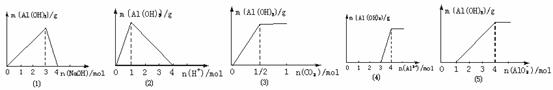
2.铝三角之间的转换及其图像
在Al3+、Al(OH)3、AlO2-之间的相互转化反应中,都有特定的数量关系。其中的定量关系可用数学中数形结合的思想加以分析,现概括如下:
⑴在适量的可溶性铝盐溶液中逐滴加入NaOH溶液至过量:
现象:立即产生白色沉淀→渐多→最多(n(NaOH)∶n(Al3+)=3∶1)→渐少→消失(n(NaOH)∶n(Al3+)=4∶1),见下图⑴。
⑵在适量的偏铝酸盐溶液中逐滴加入稀盐酸至过量:
现象:立即产生白色沉淀→渐多→最多(n(H+)∶n(AlO2-)=1∶1)→渐少→消失(n(H+)∶n(AlO2-)=4∶1),见下图⑵。
⑶在适量的偏铝酸盐溶液中缓慢通入CO2至过量:现象:立即产生白色沉淀→渐多→最多(n(CO2)∶n(AlO2-)=1∶2)→沉淀不消失。见下图⑶。
⑷在适量强碱性溶液中逐滴加入铝盐溶液至过量:
现象:局部产生白色沉淀→振荡消失→白色沉淀→渐多→最多(n(OH)-∶n(Al3+)=(3∶1)→不消失。见下图⑷。
⑸在适量强酸性溶液中逐滴加入偏铝酸盐溶液至过量
现象:局部产生白色沉淀→振荡消失→白色沉淀→渐多→最多。见下图⑸。
1.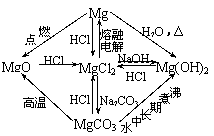
 以Al2O3、MgCl2为中心的转化关系图
以Al2O3、MgCl2为中心的转化关系图
3.焰色反应
⑴概念:多种金属或它们的化合物在燃烧时使火焰呈特殊的颜色,这在化学上叫焰色反应,该反应属物理变化。
⑵用品:铂丝(或铁、铬、镍、钨等)、酒精灯(或煤气灯)、试剂。
⑶操作:进行焰色反应的操作,应把装在玻璃棒上的铂丝放在酒精灯火焰里灼烧,等到与原来火焰颜色相同的时候,蘸上要检验的溶液,放在火焰上观察火焰的颜色。观察钾的火焰颜色的时候,要透过蓝色的钴玻璃片去观察,这样可以滤去黄色的光,避免其中钠元素杂质所造成的干扰。
2.碱金属的性质规律与特例
⑴通常合金多呈固态,而钠钾合金却是液态。
⑵碱金属单质在空气或氧气中燃烧时,生成过氧化物甚至比过氧化物更复杂的氧化物,而Li只生成Li2O。
⑶碱金属单质密度一般随核电荷数增大而递增,但K的密度比Na小。
⑷碱金属单质一般跟水剧烈反应,但Li跟水反应缓慢(LiOH溶解度小)。
⑸碱金属单质因其活动性强,多保存在煤油中,而Li却因密度比煤油更小,只能保存在液体石蜡中。
⑹碱金属的盐一般都易溶于水,但Li2CO3却微溶。
⑺一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。
⑻Fr是放射性元素,所以在自然界中不存在。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com