
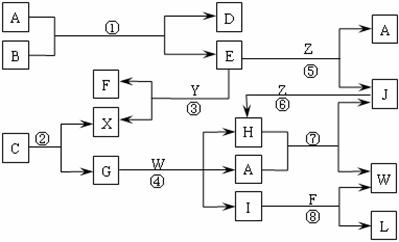
6. 下图表示各物质之间的转化关系。已知:
Ⅰ.A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
Ⅱ.G、X、Y、Z是单质,其它是化合物,其中Y呈黄绿色、H呈红棕色,E和F都极易溶解于水,二者相遇会有白烟生成;
Ⅲ.B和C都是由一种金属与一种非金属元素组成的化合物,其中非金属元素相同且质量分数都是28%,组成B的金属元素原子核外的K层和M层电子数相同。
请按要求填空:
⑴写出下列物质的电子式:A________________,X________________;
⑵工业上制取硝酸的反应有(填写反应代号):_____________________;
⑶写出下列物质的化学式:B___________,C___________;
⑷反应④的化学方程式为:_____________________________________________。
⑸保持容器的温度和体积不变,在反应③刚好完全发生时,反应前后容器的压强之比为__________。
5. A、B、C、D分别代表硝酸银、偏铝酸钠、稀盐酸、浓氨水四种无色溶液中的一种。甲、乙两同学分别用两两混合的方法进行了如下图所示的实验,现象有的相同,有的不同,不同部分已标出。
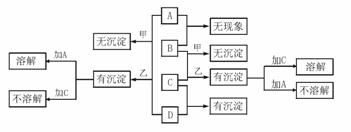
⑴试写出A、B、C、D所代表物质的化学式:
A:____________、B:____________、C:____________、D:____________。
⑵写出B和C按物质的量之比为1:3时反应的化学方程式_____________________。
⑶写出A和D按物质的量之比为3:1时反应的离子方程式_____________________。
4. A、B、C是短周期元素的三种常见非金属单质,常温下B为无色气体,A、C为固体。甲、乙、丙为中学常见的三种化合物,常温下C易溶于乙中。A、B、C与甲、乙、丙之间的转化关系如下图所示:试回答下列问题:
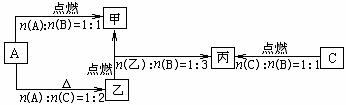
⑴C易溶于乙中的原因:_____________________________。
⑵甲的电子式:__________。
⑶下列物质能用来鉴别甲和丙的是:_________(填序号)。
①溴水;②BaCl2溶液;③Ca(OH)2溶液;④酸性KMnO4溶液;⑤品红溶液;⑥石蕊试液。
⑷写出乙在气体B中燃烧的化学方程式:___________________________________。
⑸写出甲与NaOH溶液反应的离子方程式____________________________________。
3. 由A、D、E、G四种微粒组成的盐可表示为xAaDd·yE2D·zG(其中x、y、z均为系数)。取该盐4.704克溶于水得一澄清的弱酸性溶液,其中溶质的质量为3.408克。同质量的该盐与5.13克Ba(OH)2充分混匀后加热,生成的气体用足量的铝盐溶液充分吸收得Al(OH)3为0.624克,加热后的残渣用水溶解后过滤,滤液以酚酞为指示剂用0.400摩/升的H2SO4滴定至终点,用去H2SO4为15.0毫升,滴定完毕后,溶液检测不出任何金属离子和酸根离子,滤渣用HNO3洗涤时部分溶解,得一遇石炭酸显紫色的黄色溶液,依据推理、计算,将结果填入下列空格内。 ⑴A、D、E、G四种微粒分别为__________;⑵推算x、y、z之比为____________;
⑶推算a、d之比值为___________________;⑷该盐的化学式为________________。
2. 有一钠块放置于潮湿空气中,表面氧化变质,但仍为白色块状固体,称其质量为25g,将其全部投入足量水中反应,得到溶液1000mL,并收集到气体2.24L(标准状况下的纯净物),再取此溶液100mL,用1mol/L的盐酸滴定至中性,用去70mL,并将滴定过程中产生的气体通入到足量的澄清石灰水中,得到干燥的沉淀1g,则金属钠的氧化率为
A.71.4% B.81.6% C.18.4% D.28.6%
1.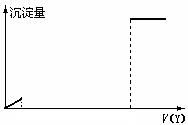 X、Y是下列浓度均为0.1mol·L-1的溶液中的某一种:①混有少量盐酸的MgSO4溶液 ②Al2(SO4)3溶液 ③明矾溶液 ④Ba(OH)2溶液 ⑤NaOH溶液。现向溶液X中逐滴加入溶液Y,得到的沉淀量与所加Y溶液的体积的关系的部分图像如右图所示,则符合该图像的共有_______种组合
X、Y是下列浓度均为0.1mol·L-1的溶液中的某一种:①混有少量盐酸的MgSO4溶液 ②Al2(SO4)3溶液 ③明矾溶液 ④Ba(OH)2溶液 ⑤NaOH溶液。现向溶液X中逐滴加入溶液Y,得到的沉淀量与所加Y溶液的体积的关系的部分图像如右图所示,则符合该图像的共有_______种组合
A.5种 B.6种 C.8种 D.10种
0.3 mol 0.4 mol
反应时FeCl3不足,生成的FeCl2根据FeCl3计算,n(FeCl2) 0.6
mol,
0.6
mol,
相当于6 mol·L-1,选项C正确。本题应选BC。
[例2]⑴如下图所示,现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后,溶液颜色变浅,产生上述现象的原因是
________________________________________________(请用相关的反应方程式和简要文字说明)。
⑵当氯水中不再产生气泡时,某学生欲检验该反应所产生的气体,则该同学可采取的合理操作是 (说明:氯水有一定腐蚀性,操作时需戴橡胶手套)
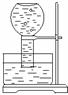
⑶在氯水中存在多种分子和离子,也可以通过实验的方法加以确定。下列说法错误的是
A.加入含有NaOH的酚酞试液,红色褪去,说明有H+离子存在
B.加入有色布条后,有色布条褪色,说明有HClO分子存在
C.氯水呈浅黄绿色,且有刺激性气味,说明有C12分子存在
D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-离子存在
[分析]⑴氯气溶于水时发生反应Cl2+H2O HCl+HClO,光照时2HClO
HCl+HClO,光照时2HClO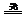 2HCl+O2↑,产生气体,同时使氯气与水反应的平衡向正反应方向移动,消耗Cl2,使溶液颜色变浅。⑵在水面下用玻璃片盖住瓶口,小心地将烧瓶移出水槽,瓶口向上放于桌上,移开玻璃片,迅速伸入带火星的木条。⑶在氯水中加入NaOH溶液,红色褪去的原因是由于HClO的强氧化性而漂白,可以用下列实验加以验证,在褪色后的溶液中再加入NaOH溶液,发现溶液仍为无色,本题应选A。
2HCl+O2↑,产生气体,同时使氯气与水反应的平衡向正反应方向移动,消耗Cl2,使溶液颜色变浅。⑵在水面下用玻璃片盖住瓶口,小心地将烧瓶移出水槽,瓶口向上放于桌上,移开玻璃片,迅速伸入带火星的木条。⑶在氯水中加入NaOH溶液,红色褪去的原因是由于HClO的强氧化性而漂白,可以用下列实验加以验证,在褪色后的溶液中再加入NaOH溶液,发现溶液仍为无色,本题应选A。
[例3]某同学为研究硝酸与镁的反应,进行图示实验,实验现象及相关数据如下:(a)A中为一定浓度的硝酸与Mg片发生反应,生成的气体通过B后,在B中只生成一种盐,剩余气体遇空气不变色,其体积为原体积的一半。(b)从C进入D中的气体有两种,且体积比为1∶1。(c)将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)
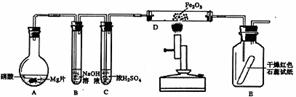
已知反应中水蒸气的体积忽略不计,实验中的液体药品均过量。请回答:
⑴硝酸与Mg片反应生成的气体成分是___________________________(用化学式表示)。
⑵硝酸在装置A的反应中所表现的性质有____________________________________。
⑶写出D中发生反应的化学方程式__________________________________________。
⑷若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的1/4(同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式_________。
[分析]NO2气体与NaOH溶液反应的化学方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O,NO与NaOH溶液不反应,但有NO2+NO+2NaOH=2NaNO2+H2O,结合(a)说明产物中有NO和NO2两种气体且两者的比例为1:1。结合(a)(b)知Mg和HNO3反应的产物中有4种气体生成,且物质的量相等。结合(c)可知E中生成的气体是NH3,反推知由N2和H2合成。通过⑷说明HNO3的还原产物中还存在NH4+,其物质的量和每一种气体的物质的量相等,最后可根据得失电子守恒把化学方程式配平。答案为:⑴NO NO2 N2 H2 ⑵酸性 氧化性 ⑶Fe2O3+3H2 2Fe+3H2O N2+3H2
2Fe+3H2O N2+3H2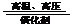 2NH3
2NH3
⑷12Mg+3OH++5NO3-=12Mg2++NH4++NO2↑+NO↑+N2↑+H2↑+12H2O
[例4]生铁中一般含有化合物B,它的含量、形状、分布对生铁性能影响很大,使生铁硬而脆,不
宜进行机械加工。已知:⑴E、F、H、I、P常温下为气体,H、I、P为单质,E是一种经棕色气体。⑵反应①②均为制备理想的绿色水处理剂Na2FeO4的方法,其中反应①在生成Na2FeO4的同时还生成NaNO2和H2O。各物质之间的转化关系如下图所示(图中部分生成物没有列出)。

请填写以下空白:
⑴写出F的电子式_________。⑵反应③的离子方程式为_____________________;
⑶反应①的化学方程式为____________________________。
[分析]常温下F是一种气体且能和Na2O2反应生成单质H,则H为O2,F为CO2,N为Fe2O3,红棕色气体E为NO2,应是氧化性酸HNO3的还原产物,可考虑A为HNO3,化合物B应是由元素Fe和C构成的化合物(本题中由于条件不足,问题中没有让学生回答未知物的化学式),和HNO3发生氧化还原反应,D应是H2O,C可能是Fe(NO3)2或Fe(NO3)3,由于G的水溶液电解生成2种气体I和P,所以G是NaCl,产物J能和HNO3反应,所以J是NaOH,I是Cl2,P是H2,K是NaNO3。答案为:
⑴ 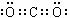 ⑵2Cl-+2H2O
⑵2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
⑶Fe2O3+3NaNO3+4NaOH=2Na2FeO4+3NaNO2+2H2O
[专题演练]
0.05 0.05×2 0.05 0.05×2
则第①组反应完全后剩余的FeCl3 0.4-0.05×2-0.05×2
0.4-0.05×2-0.05×2 0.2
mol,
0.2
mol,
相当于2 mol·L-1,选项A错。
由上可得若混合粉末的质量为36 g,则铁和铜各0.3 mol,
Fe + 2FeCl3  3FeCl2(先)
3FeCl2(先)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com