
10. 一定量的有机物溶于适量的NaOH溶液中,滴入酚酞试液呈红色,煮沸5分种后,溶液颜色变浅,再加入盐酸显酸性时,沉淀出白色晶体,取少量晶体放到FeCl3溶液中,溶液呈紫色。则该有机物可能是:
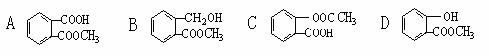
9. 一种新型熔融盐燃料电池具有高发电效率而倍受重视。现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650℃时工作的燃料电池,其电池总反应是2CO+O2=2CO2。则下列说法中正确的是
A. 通CO的一极是电池的正极
B. 正极电极反应是:O2+2CO2+4e-=2CO32-
C. 熔融盐中CO32-的物质的量在工作时保持不变
D. 电池工作时,CO32-向正极移动
8.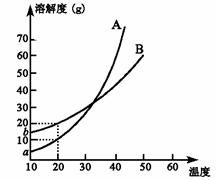 A、B两种化合物溶解度曲线如右图,现要求用结晶法
A、B两种化合物溶解度曲线如右图,现要求用结晶法
从A、B混合物中提取A(不考虑A、B共存时对各自
溶解度的影响)。取50 g混合物将其溶于100 g热水
中然后冷却至20 ℃,若要使A析出而B不析出,
则混合物中B的质量分数最高不能超过:
A.20% B.30% C.40% D.50%
7.某酸根离子RO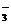 所含电子数比硝酸根离子NO
所含电子数比硝酸根离子NO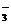 的电子数多10,则下列说法正确的是:
的电子数多10,则下列说法正确的是:
①R原子的电子层数比N原子的电子层数多1 ②RO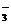 中R元素与NO
中R元素与NO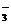 中N元素的化合价相同 ③RO
中N元素的化合价相同 ③RO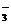 与NO
与NO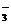 只可能被还原,不可能被氧化 ④R和N不是同周期元素,但是同主族元素
只可能被还原,不可能被氧化 ④R和N不是同周期元素,但是同主族元素
A.①③④ B.①②④ C.①② D.③④
6.下列实验现象的解释正确的是
|
|
实验现象 |
解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
淀粉能与Cl2发生显色反应 |
|
B |
胶体的微粒可以透过滤纸,不能透过半透膜 |
胶体的微粒直径介于1-100nm之间 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
一定是由于该溶液中含有SO42- |
|
D |
铜片放入冷的浓硫酸中,无明显变化 |
铜在冷的浓硫酸中发生钝化 |
5.下列情况下,离子一定可以大量共存的是:
A.常温下pH=7的溶液:Na+ SO42- Fe3+ Cl-
B.常温水电离的c(H+)=10-13mol/L的溶液:K+ Cl- Ca2+ ClO-
C.HC03-大量存在的溶液:Ca2+ NO3- K+ Cl-
D.加入铝可以产生氢气的溶液:NH4+ SO42- K+ NO3-
4.下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中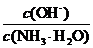 增大
增大
3.NA代表阿伏加德罗常数值,下列说法正确的是
A.在0.2L 0.5mol/LAlCl3溶液中Al3+数目为0.1NA
B.1 mol MgCl2晶体中含有离子数为NA
C.7.1 g氯气与足量NaOH溶液反应转移的电子数为0.2 NA
D. 1 mol C10H22分子中共价键总数为31 NA
2.下列说法或表示正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
C.稀溶液中:H+(aq)+OH-(aq)  H2O(l); △H=-57.3kJ/mol,若将含0.5molH2SO4
H2O(l); △H=-57.3kJ/mol,若将含0.5molH2SO4
的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,H2燃烧的热化学方程式为:2H2(g)+O2(g) = 2H2O(l);
△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol
1.中国科学院在世界上首次发现铂元素的一种核素202 78Pt,下列有关叙述错误的是
A.铂元素原子的核外电子数为78 B.铂元素的原子序数为202
C.该原子核内有124个中子 D.该原子的质量数为202
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com