
下图中,沿甲图E-F、M-N所作的地形剖面分别为乙图和丙图。读图回答5-8小题。

5.该地的地形是:
A.山峰 B.山脊 C.山谷 D.鞍部
6.①地比②地:
A.海拔高,坡度大 B.海拔高,坡度小
C.海拔低,坡度大 D.海拔低,坡度小
7.③地位于④地的:
A.东北方向 B.东南方向 C.西北方向 D.西南方向
8.在一次较大的降水过程中,降落在④地的雨水在坡面上的流向是:
A.东北向西南 B.东南向西北
C.西南向东北 D.西北向东南
4.地中海型气候区的植物,具有“树干低而多节,树皮厚,叶小但表皮似涂脂”的特征,这些特征的出现是为了适应:
A.冬暖湿,但雨日不多的气候 B.干湿分明的降雨特征
C.干热的夏季 D.贫瘠的土壤
3. 下图所表示的地理事物或地理现象的形成或演变过程正确的是:
下图所表示的地理事物或地理现象的形成或演变过程正确的是:
 右图是甲、乙两地各月温度差和降水差(甲地各月气温减去乙地各月气温,甲地各月降水减去乙地各月降水)示意图,据此回答1-2题。
右图是甲、乙两地各月温度差和降水差(甲地各月气温减去乙地各月气温,甲地各月降水减去乙地各月降水)示意图,据此回答1-2题。
1.下列各图能正确表示甲、乙两地气候类型的是:

A.①-甲、②-乙 B.③-甲、④-乙
C.③-甲、①-乙 D.④-甲、②-乙
2.形成甲、乙两地气候的主要因素中,相似的是:
A.大气环流 B.纬度 C.地面状况 D.暖流
17、 (13分) 已知:
(13分) 已知:
物质A在体内脱氢酶的作用下会氧化为有害物质GHB。下图是关于物质A的一种制备方法及由A引发的一系列化学反应。
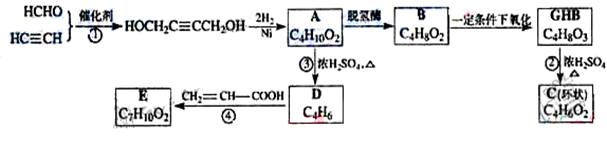

请回答下列问题:
(1)写出反应类型:反应①____________,反应③____________。
(2)写出化合物B的结构简式_____________________________。
(3)写出反应②的化学方程式____________________________。
(4)写出反应④的化学方程式____________________________。
(5)和GHB具有相同官能团的同分异构有4种,其中两种为:

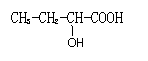
请写出另外两种的结构简式: 。
(6)反应④中除生成E外,还可能存在一种副产物(含 结构),它的结构简式为________________。
结构),它的结构简式为________________。
(7)与化合物E互为同分异构体的物质不可能为________(填写字母)。
a、醇 b、醛 c、羧酸 d、酚
16、 (6分)在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(6分)在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
 (1)计算在20至40秒时间内,NO2的平均
(1)计算在20至40秒时间内,NO2的平均
生成速率为 。
(2)下表是不同温度下测定得到的该反应
的化学平衡常数。
|
T/ K |
323 |
373 |
|
K值 |
0.022 |
0.36 |
据此可推测该反应(生成NO2的方向)是 反应(选填“吸热”或“放热”)
(3)若其他条件不变,反应在423K时达到平衡,平衡常数 (填“增大”、“减小”或“不变”)。并请在上图中画出此温度下的反应进程曲线示意图。
15、(8分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
(1)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式: ;
(2)铜和水在通常情况下不发生反应,某同学设计了电解装置,实现了该反应。请写出电解条件下的反应方程式,并在装置图中标出电极材料及溶液中的电解质(用化学式表示)。
14、(13分) 工业生产硝酸铵的流程图如下:
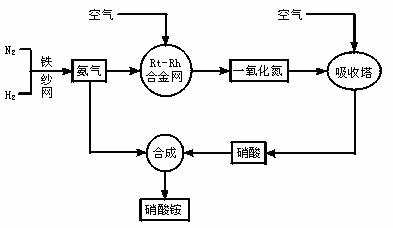
请回答下列问题:
(1)写出硝酸铵在工农业生产中的主要用途_______________________(任写一条)
(2)已知N2(g)+3H2(g) 2NH3(g),ΔH=-92 kJ·mol-1。请回答:
2NH3(g),ΔH=-92 kJ·mol-1。请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是_________________。
②为有效提高氢气的转化率,实际生产中宜采取的措施有____________
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(3)写出氨在铂铑合金网催化氧化的化学方程式:_________________________________________________________________
(4)在一定温度和压强的密闭容器中,将物质的量为3:2的H2和N2混合,当该反应达到平衡时,测出平衡混合气中氨的体积分数为15%,此时H2的转化率为_______________。
(5) 请写出实验室检验产品中阳离子的方法: 。
(6) 硝铵受热会发生爆炸,在某温度下反应生成N2,其中被氧化和被还原的氮原子为5:3,请写出该反应的化学方程式: 。
12、(13分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设:
假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? ,简述你的理由(不需写出方程式 ) 。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末 ,写出发生反应的离子方程式:
、 、 。
探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
(5)某铝土矿样品经测定是由Al2O3、Fe2O3、 FeO、 SiO2等氧化物组成,请设计一简单实验,确定矿物中含有+2价的铁(写出所用试剂,操作方法和结论)。
可以选用的试剂:2mol/LHCl溶液、2mol/LH2SO4溶液、2mol/LNaOH溶液、KSCN溶液、
KMnO4溶液、3%的H202溶液。
13(11分)实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。

请回答下列问题:
(1)操作Ⅰ的名称为 ,操作Ⅱ所需要的玻璃仪器有 。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。 。
(3)若实验所得固体甲的质量为W 1g,则样品中K2SO4的质量分数计算式为:
。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称。

11.一定温度下,将2molA、2molB、2molC的混合气体充入一体积不变的密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是:

 A. 2A + B 2C B. A + B 2C
A. 2A + B 2C B. A + B 2C

 C. 2A + B C D. A +
B 3C
C. 2A + B C D. A +
B 3C
第Ⅱ卷 非选择题(共64分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com