
7. 在20.0 mL 0.10 mol·L-1的盐酸溶液中滴加0.10mol·L-1 NaOH溶液,并以酚酞为指示剂。
⑴填写下表中的空格(结果保留一位小数)。
|
① V(NaOH)(mL) |
0.00 |
18.00 |
19.80 |
19.96 |
19.98 |
20.00 |
20.02 |
20.04 |
20.20 |
|
②溶液的pH |
1.0 |
2.3 |
3.3 |
|
4.3 |
7 |
9.7 |
|
10.7 |
⑵根据上表中的数据,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意
图,并指出该滴定曲线的特点。
⑶一般中和滴定操作要求误差≤0.1%,其关键之一是选择合适的指示剂来确定终点。你认为能否用甲基橙作上述反应的指示剂,说明理由。
⑷其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度_____(填“大”、“小”或“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42 -为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
6. 下面是4种有机弱酸,强弱顺序为:CHCl2COOH> >CH2ClCOOH>
>CH2ClCOOH> ,下列说法中不正确的是
,下列说法中不正确的是
A.等浓度等体积的4种酸中和碱的能力: >CHCl2COOH
>CHCl2COOH CH2ClCOOH
CH2ClCOOH

B.等浓度的4种酸溶液中水电离出的c水(H+): >CH2ClCOOH>
>CH2ClCOOH> >CHCl2COOH
>CHCl2COOH
C.反应 + 2CH2ClCOO-
+ 2CH2ClCOO-
 +2CH2ClCOOH一定能够发生
+2CH2ClCOOH一定能够发生
D.由题中信息可推知酸性:CH2FCOOH>CH2ClCOOH
5. 某温度下,某一元酸HA溶液的pH为b,且有n(A-):n(HA) = 1:99。某一元强碱溶液的pH为a。若将1体积的此强碱溶液与10体积的HA溶液混合,恰好完全反应。则a与b之和为
A.18 B.17 C.16 D.15
4. 下列说法正确的是
A.Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C.泡沫灭火器中常使用的原料是碳酸氢钠和硫酸铝
D.为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH
2. 下列文字表述与反应方程式对应且正确的是
A.亚硫酸溶液电离:H2SO3+2H2O 2H3O++SO32-
2H3O++SO32-
B.ICl固体溶于水:ICl+H2O==HI+HClO
|
 NH3·DHO+D3O+
NH3·DHO+D3O+
 D.乙酸乙酯的水解:CH3COOCH2CH3
+H218O CH3COOH
+CH3CH218OH
D.乙酸乙酯的水解:CH3COOCH2CH3
+H218O CH3COOH
+CH3CH218OH
3. 下图中坐标轴分别表示阴、阳离子的浓度,图中曲线表示某物质的溶度积(Ksp),符
合该曲线的物质是
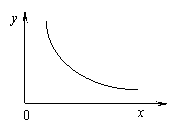 A.AgI B.Ag2CrO4 C.Fe(OH)3 D.Mg(OH)2
A.AgI B.Ag2CrO4 C.Fe(OH)3 D.Mg(OH)2
1. 常温离子液体(Ionic Liquid)也称常温熔融盐。硝酸乙基铵((C2H5NH3)NO3)是人类发现的第一种常温离子液体,其熔点为12℃。已知(C2H5NH3)NO3的水溶液显弱酸性。下列说法中不正确的是
A.C2H5NH2可视作一元强碱 B.(C2H5NH3)NO3属于离子化合物
C.(C2H5NH3)NO3是一种强电解质 D.(C2H5NH3)NO3溶液中存在2种平衡
2.难溶物向易溶物转化
分析化学中常将难溶的强酸盐(如BaSO4)转化为难溶的弱酸盐(如BaCO3),然后再用酸溶解使正离子(Ba2+)进入溶液。BaSO4 沉淀转化为BaCO3沉淀的反应为BaSO4 (s)+
CO32- BaCO3(s) + SO42-
BaCO3(s) + SO42-
 ,虽然平衡常数小,转化不彻底,但只要c(CO32-)比c( SO42-)大24倍以上,经多次转化,即能将BaSO4转化为BaCO3。
,虽然平衡常数小,转化不彻底,但只要c(CO32-)比c( SO42-)大24倍以上,经多次转化,即能将BaSO4转化为BaCO3。
[思想方法]
[例1]常温下的下列情况中,一定能大量共存于同一溶液中的离子组是
A.使甲基橙呈红色的溶液中:I-、Cl-、NO3-、Na+
B.使石蕊呈蓝色的溶液中:NH4+、Al3+、NO3-、HCO3-
C.由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:K+、Cl-、NO3-、Na+
D.澄清透明溶液中:K+、Cu2+、Na+、Cl-
[分析]选项A中,附加条件是能使甲基橙呈红色,说明溶液呈强酸性,因此在酸性溶液中I-和NO3-将发生氧化还原反应而不能大量共存。选项B中,附加条件是能使石蕊呈蓝色,说明溶液呈强碱性,因此NH4+、Al3+、HCO3-均不能大量共存,同时Al3+与HCO3-也会发生双水解反应而不能大量共存于同一溶液中。选项C中附加条件是由水电离出的c(H+)=1×10-12 mol·L-1的溶液中,说明水的电离遭到抑制,溶液可能呈酸性也可能呈碱性,题给4种离子不论在酸性条件下还是在碱性条件下均可以大量共存,选项D中附加条件是澄清透明溶液中,“澄清透明”是溶液的特征,不能把“澄清透明”误解为“无色溶液”,因此选项D也符合题意。应选CD。
[例2]下列离子方程式书写不正确的是
A.NaOH溶液与足量的Ca(HCO3)2反应:HCO3- +OH-+Ca2+ = CaCO3↓+H2O
B.等物质的量的FeBr2和Cl2反应:2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4Cl-
C.氨水吸收少量的二氧化硫:2NH3·H2O+SO2 = 2NH4+ +SO32 -+H2O
D.在强碱溶液性中NaClO与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3 2FeO42 -+3Cl-+H2O+4H+
2FeO42 -+3Cl-+H2O+4H+
[分析]当遇到未知反应时不要慌张,判断未知反应正确与否的方法是:一要符合三大守恒,即质量守恒、电荷守恒、得失电子守恒,二要注意介质是否正确,选项D中很明显在强碱溶液中不可能有H+生成,因此可快速判断D中反应是错误的,而对于该反应到底是如何进行的没有必要细究。本题应选D。
[例3]下列关系式中正确的是
A.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数大小:N前>N后
B.0.1 mol·L-1Na2S溶液中:2c(Na+) c(S2-)+c(HS-)+c(H2S)
c(S2-)+c(HS-)+c(H2S)
C.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl-)>c(CH3COOH)
D.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合
c(CO32 -)+2c(OH-) c(HCO3- )+3c(H2CO3)+2c(H+)
c(HCO3- )+3c(H2CO3)+2c(H+)
[分析]选项A中NaClO(aq)与NaCl(aq)中电荷守恒式分别为c(Na+)+c(H+) c(ClO-)+c(OH-)、c(Na+)+c(H+)
c(ClO-)+c(OH-)、c(Na+)+c(H+) c(Cl-)+c(OH-),由于NaClO水解显碱性,因此有c(H+)NaClO<c(H+)NaCl,所以NNaClO<NNaCl,A错。选项B中的物料守恒式应为
c(Cl-)+c(OH-),由于NaClO水解显碱性,因此有c(H+)NaClO<c(H+)NaCl,所以NNaClO<NNaCl,A错。选项B中的物料守恒式应为 c(Na+)
c(Na+) c(S2-)+c(HS-)+c(H2S)。选项C可以这样分析:先写出混合溶液的电荷守恒式:c(H+)+c(Na+)
c(S2-)+c(HS-)+c(H2S)。选项C可以这样分析:先写出混合溶液的电荷守恒式:c(H+)+c(Na+) c(OH-)+ c(Cl-)+ c(CH3COO-),又由于溶液呈中性即c(H+)=c(OH-),因此混合溶液中应有c(Na+)
c(OH-)+ c(Cl-)+ c(CH3COO-),又由于溶液呈中性即c(H+)=c(OH-),因此混合溶液中应有c(Na+) c(Cl-)+c(CH3COO-),根据物料守恒可得c(Na+)
c(Cl-)+c(CH3COO-),根据物料守恒可得c(Na+) c(CH3COOH)+c(CH3COO-),所以有c(Na+)>c(Cl-)
c(CH3COOH)+c(CH3COO-),所以有c(Na+)>c(Cl-) c(CH3COOH),C错。本题应选D。
c(CH3COOH),C错。本题应选D。
[例4]已知:CH3COOH CH3COO-+H+达到电离平衡时,电离平衡常数用Ka表示;CH3COO-+H2O
CH3COO-+H+达到电离平衡时,电离平衡常数用Ka表示;CH3COO-+H2O CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh= 。
。
⑴对于任意弱电解质来讲,其电离平衡常数K、对应离子的水解常数Kh以及水的离子积常数Kw的关系是________________________;由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度___________。
⑵由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol/L的CH3COOH溶液中c(H+)=____________(不为0);
⑶现用某未知浓度(设为c)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;
②___________________________;
③用________________________(填一种实验方法)测定溶液浓度c。
⑷若测得25℃时CH3COOH的电离平衡常数K=1.8×10-5,则该温度下0.18 mol/L的CH3COONa溶液的pH=______________。
[分析]第⑵题中强调c(H+)不为0是为了防止有的考生从“计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度”得到“CH3COOH不电离”的错误结论。由于CH3COOH电离出的CH3COO-与H+浓度近似相等,c(CH3COOH)又可看成是CH3COOH溶液的浓度c,则Ka=[c(H+)]2/c,c(H+)= mol·L-1,要测定Ka,则必须要分别用pH换算c(H+)和用酸碱中和滴定的方法测定c。同理,CH3COONa溶液中c(OH-)=
mol·L-1,要测定Ka,则必须要分别用pH换算c(H+)和用酸碱中和滴定的方法测定c。同理,CH3COONa溶液中c(OH-)= =
=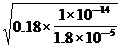 mol·L-1=10-5 mol·L-1,pH=9。
mol·L-1=10-5 mol·L-1,pH=9。
[答案]⑴Ka·Kh=Kw 越大 ⑵ mol·L-1 ⑶②溶液的pH ③酸碱中和滴定 ⑷9
mol·L-1 ⑶②溶液的pH ③酸碱中和滴定 ⑷9
[例5]化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:

⑴在上述有编号的步骤中,反应①所用的试剂是H2O2,反应⑤所用的试剂是Cl2,反应⑥是加酸酸化。请写出上述反应的离子方程式___________________________、____________________________、_____________________________。
⑵写出Cr(OH)3在水溶液中的电离方程式___________________________________。
⑶现有含Cr3+、Fe3+的溶液,使用NaOH溶液和盐酸溶液,可将这两种离子相互分离,在涉及到的过滤操作中,上述两种离子的存在形态分别是______、_______(写化学式)。
⑷若是Cr3+和Al3+的混合溶液,欲使这两种离子相互分离,依次加入的试剂是①NaOH、②_______、③CO2、④HCl和_________。写出向溶液中通入足量CO2时,反应的离子方程式为________________________。
⑸如下图所示:横坐标为溶液的pH,纵坐标为Al3+离子、AlO2- 离子物质的量浓度的对数,回答下列问题:
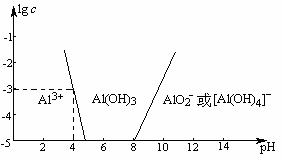
从图中数据计算可得Al(OH)3的溶度积 ____________。往10 mL2.00 mol·L-1AlCl3溶液中加入NaOH固体至pH
____________。往10 mL2.00 mol·L-1AlCl3溶液中加入NaOH固体至pH 3,需NaOH_______mol。
3,需NaOH_______mol。
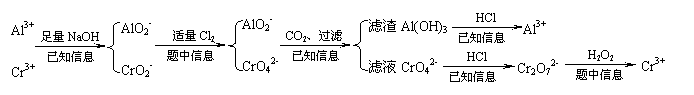 [分析]本题首先应根据图中转化关系得出Cr(OH)3呈两性的事实,书写Cr(OH)3的电离方程式时可与Al(OH)3类比。⑶中主要利用Cr(OH)3的两性、Fe(OH)3的弱碱性把两者分开。而⑷中Cr(OH)3和Al(OH)3两者均有两性,那又怎样分离呢,题中还有没有信息呢?此时应回过头来再利用⑴中的信息可以解决,根据提示,在Cr3+和Al3+的混合溶液中先加入足量的烧碱,使其转化为CrO2- 和AlO2- ,此时若直接通入CO2气体,则有可能同时析出Cr(OH)3和Al(OH)3沉淀,则达不到分离的目的。因此再利用图示转化关系和⑴中信息知,在CrO2- 和AlO2- 的混合溶液中先通入Cl2,把CrO2- 氧化成CrO42 -,然后再通入CO2气体,此时只析出Al(OH)3沉淀,过滤后,酸化溶液,使CrO42 -转化为Cr2O72-,再加入H2O2,使其重新转化为Cr3+,达到了分离的目的。分离过程可表示为:
[分析]本题首先应根据图中转化关系得出Cr(OH)3呈两性的事实,书写Cr(OH)3的电离方程式时可与Al(OH)3类比。⑶中主要利用Cr(OH)3的两性、Fe(OH)3的弱碱性把两者分开。而⑷中Cr(OH)3和Al(OH)3两者均有两性,那又怎样分离呢,题中还有没有信息呢?此时应回过头来再利用⑴中的信息可以解决,根据提示,在Cr3+和Al3+的混合溶液中先加入足量的烧碱,使其转化为CrO2- 和AlO2- ,此时若直接通入CO2气体,则有可能同时析出Cr(OH)3和Al(OH)3沉淀,则达不到分离的目的。因此再利用图示转化关系和⑴中信息知,在CrO2- 和AlO2- 的混合溶液中先通入Cl2,把CrO2- 氧化成CrO42 -,然后再通入CO2气体,此时只析出Al(OH)3沉淀,过滤后,酸化溶液,使CrO42 -转化为Cr2O72-,再加入H2O2,使其重新转化为Cr3+,达到了分离的目的。分离过程可表示为:
⑸根据Al(OH)3的溶度积的表达式Ksp = c(Al3+)·c(OH-)3易得溶度积常数为1×10-33,写不写单位无关。当pH = 3时,根据图像可得Al3+转化为Al(OH)3沉淀,根据溶度积常数可求得此时溶液中剩余c(Al3+) = Ksp/ c(OH-)3 = 1 mol·L-1,则有0.01 mol Al3+转化为沉淀,根据离子方程式Al3++3OH- = Al(OH)3↓可得消耗烧碱0.03 mol。
[答案]⑴Cr2O72-+3H2O2+8H+ 2Cr3++3O2↑+7H2O
2Cr3++3O2↑+7H2O
2CrO2- +3Cl2+8OH-  2CrO42 -+6Cl-+4H2O 2CrO42 -+2H+
2CrO42 -+6Cl-+4H2O 2CrO42 -+2H+  Cr2O72-+H2O(1分)
Cr2O72-+H2O(1分)
⑵H+ +CrO2- +H2O Cr(OH)3
Cr(OH)3 Cr3++3OH-
Cr3++3OH-
⑶Fe(OH)3 CrO2-
⑷Cl2 H2O2 AlO2- +CO2+2H2O  Al(OH)3↓+HCO3-
Al(OH)3↓+HCO3-
⑸1×10-33 0.03
[专题演练]
1.易溶物向难溶物转化
如向BaCO3 沉淀中加入Na2CrO4溶液,将会发现白色的BaCO3 固体逐渐转化成黄色的 BaCrO4 沉淀。为什么产生这现象呢?
可根据溶度积规则分析。当加入少量CrO42- 时,c(Ba2+)·c(CrO42-)< ,这时不生成BaCrO4沉淀。继续加入CrO42-,必将有一时刻刚好达到 Q =
,这时不生成BaCrO4沉淀。继续加入CrO42-,必将有一时刻刚好达到 Q =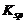 ,即 c(Ba2+)·c(CrO42-)=
,即 c(Ba2+)·c(CrO42-)= 。这时,体系中同时存在两种平衡:
。这时,体系中同时存在两种平衡:
BaCO3  Ba2+ +
CO32-
Ba2+ +
CO32-  = c(Ba2+)·c(CO32-) = 2.58×10-9 …… ①
= c(Ba2+)·c(CO32-) = 2.58×10-9 …… ①
BaCrO3  Ba2+
+ CrO42-
Ba2+
+ CrO42-  = c(Ba2+)·c(CrO42-) = 1.6×10-10
……②
= c(Ba2+)·c(CrO42-) = 1.6×10-10
……②
①-②
得:BaCO3
(s) + CrO42-  BaCrO3(s)
+ CO32- ……③
BaCrO3(s)
+ CO32- ……③
方程式③所表示的就是白色的BaCO3 转化成黄色的BaCrO4 的反应。其平衡常数为
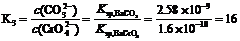
5.电解质溶液中的守恒规律
⑴电荷守恒规律:电解质溶液中,不论存在多少种离子,但溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数,也就是所谓的电荷守恒规律。如NaHCO3溶液中存在着Na+、H+、HCO3-、CO32、OH-,必存在如下关系:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)。
⑵物料守恒规律:电解质溶液中,由于某些离子能够水解,离子种类增多,但某些关键性的原子总是守恒的,如K2S溶液中S2-、HS-都能水解,故S元素以S2-、HS-、H2S三种形式存在,它们之间有如下守恒关系:c(K+)=2c(S2-)+2c(HS-)+2c(H2S)。
⑶质子守恒规律:质子守恒是指电解质溶液中粒子电离出氢离子(H+)总数等于粒子接受的氢离子(H+)总数加游离的氢离子(H+)数。如Na2S水溶液中的质子转移作用可图示如下:

由上表可得Na2S水溶液中质子守恒式可表示为:c(H3O+)+2c(H2S)+c(HS-)=c(OH-)或c(H+)+2c(H2S)+c(HS-)=c(OH-)。质子守恒的关系式也可以从电荷守恒与物料守恒推导得到。
4.有关溶液pH的简单计算
在做关于溶液的pH计算的题目时,要抓住“矛盾的主要方面”,溶液显酸性用溶液中的c(H+)来计算;溶液显碱性先求溶液中的c(OH-),再求溶液中的c(H+)。口诀:酸按酸(H+),碱按碱(OH-),酸碱中和求过量,无限稀释7为限。特别注意区分溶液中的c(H+)和由水电离的c(H+)之间的差异,否则做题时,容易落入陷阱。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com