
20.在标准状况下,1体积的水溶解了700体积的NH3,所得溶液的密度为0.9g .cm-3,则该溶液的物质的量浓度和质量分数各为多少?

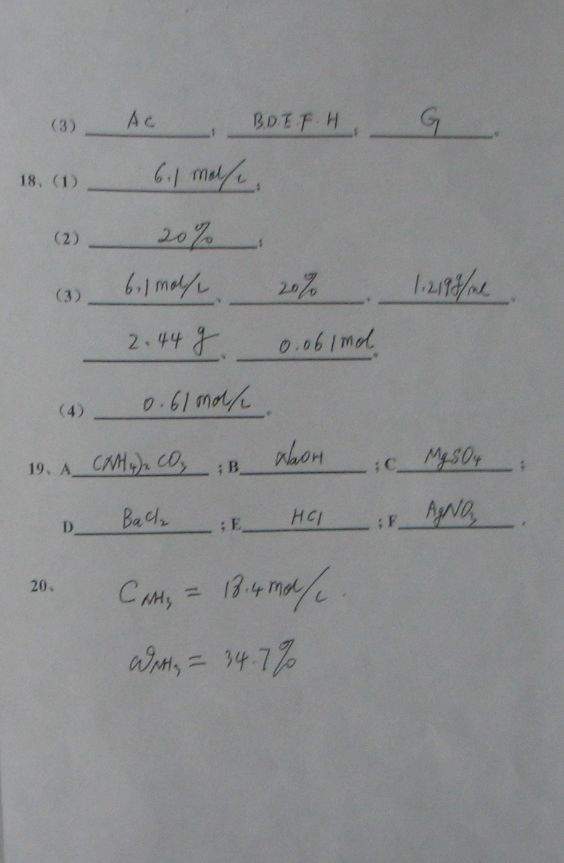
19.有A,B,C,D,E.F 6种未知溶液,它们是MgSO4 ,BaCI2,(NH4)2CO3,AgNO3,HCI和NaOH.为了鉴别它们,各取少许溶液,进行两两混合实验,结果如下表:
|
|
A |
B |
C |
D |
E |
F |
|
A |
|
↑ |
↓ |
↓ |
↑ |
↓ |
|
B |
↑ |
|
↓ |
-- |
-- |
↓ |
|
C |
↓ |
↓ |
|
↓ |
-- |
↓ |
|
D |
↓ |
-- |
↓ |
|
-- |
↓ |
|
E |
↑ |
-- |
-- |
-- |
|
↓ |
|
F |
↓ |
↓ |
↓ |
↓ |
↓ |
|
表中“↓”表示有沉淀或微溶性物质形成,“↑”表示有气体生成,“--”表示观察不到现象。
由此可判断:A是 ,B是 ,C是 ,D是 ,E是 ,F是 。
18.将24.4g氢氧化钠固体溶于水配成100mL溶液,其密度为1.219g/mL.
(1) 该溶液中氢氧化钠的物质的量的浓度为 。
(2)该溶液中氢氧化钠的质量分数为 。
(3)从该溶液中取出10mL,其中氢氧化钠的物质的量浓度为 ,氢氧化钠的质量分数为 ,溶液的密度为 ,含氢氧化钠的质量为 ,含氢氧化钠的物质的量为 。
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中氢氧化钠的物质的量浓度为 。
17. 实验室用氢氧化钠固体配置1.0mol/L的氢氧化钠溶液500ml,回答下面问题:
(1)请简要叙述该实验的实验步骤;
① ; ② ; ③ ;
④ ; ⑤ ; ⑥ ;
⑦ ; ⑧ ; ⑨ ⑩ ;
(2)所需仪器为:容量瓶(规格: )、托盘天平,还需要哪些实验仪器才能完成实验,请写出 。
(3)下列操作对所配溶液的浓度有何影响?(填写字母)
偏大的有 ;
偏小的有 ;
无影响的有 ;
A. 称量时使用了生锈的砝码
B.将氢氧化钠放在纸张上称量
C.氢氧化钠在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶中移液时,有少量液体溅出
E.未洗涤溶解氢氧化钠的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配置溶液
H.定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线
16.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.,若阿伏伽德罗常数用NA 表示,则( )
(1)该气体的物质的量为 mol.
(2)该气体所含原子总数为 个.
(3)该气体在标准状态下的体积为 L.
(4)该气体溶于1L水中(不反应)、其溶液中溶质的质量分数为 .
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为 mol/L.
15.氯化镁、氯化钾、硫酸钾三种盐配成混合液中,若溶液中n(K+ )=1.5mol,n(Mg2+)=0.5 mol ,n(CI-)=1.5 mol,则溶液中n(SO24-)应为( )
A. 0.5mol。 B.0.25mol C.0.15mol D.0.1mol
14.a g水中含有b个氢原子,则阿伏伽德罗常数为 ( )
A. 9a/b mol-1 B.9b/a 1mol-1 C.b/a mol-1 D.a/bmol-1
13.现有三组溶液:①汽油和氯化钠溶液;②39%的乙醇溶液;③氯化钠和单质碘的水溶液,分离以上各种混合液的正确方法是 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
12.0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( )
A.5:2 B. 3:1 C.15:2 D. 1:3
11.欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是( )
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
A.①② B.②③ C.①③ D.①②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com