
3. 设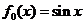 ,
,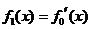 ,
,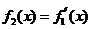 ,…,
,…,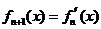 ,
,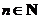 ,则
,则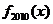 =
=
A.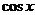 B.-
B.-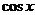 C.
C.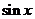 D。-
D。-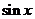
2. 化简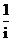 的结果是
的结果是
A.1 B.i C.-1 D.-i
1.定积分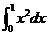 的结果是
的结果是
A.1 B. C.
C.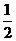 D.
D.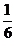
32.(8分)[物质结构与性质]
(1)已知某短周期元素的电负性是同族元素中最大的,其第一电离能高于其在周期表中直接相邻的元素,其原子最外电子层电子分布在两种形状的原子轨道中。请画出该元素最外电子层的电子排布图:
(2)已知能够自由移动的(CH3)3NH+和AlCl4 -可形成离子液体,由这两种离子形成的晶体的熔点低于100℃,则由这两种离子形成的晶体属于 晶体。
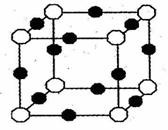 (3)X+中所有电子正好全部充满K、L、M三个电子层,它与N3-形成的晶体结构,如右图所示。请回答:
(3)X+中所有电子正好全部充满K、L、M三个电子层,它与N3-形成的晶体结构,如右图所示。请回答:
①用元素符号表示X+:
②图中O表示的是:
③N3- 的配位数是
30.(14分)根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题:
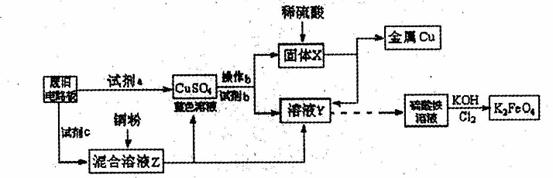
A.浓硫酸 B.硫酸铁溶液 C.氯水
D.H2 O2和稀硫酸 E. Fe
(2)加入过量试剂c,发生反应的离子方程式为__ ;溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为__ _ _(填化学式);欲测定溶液Z中Fe2+的浓度,需要用(填仪器名称)__ __配制一定浓度的KMnO4标准溶液。在滴定时KMnO4标准溶液应加入到 (填“酸式”或“碱式”)滴定管中。
(3) K2FeO4是强氧化剂,与水发生反应:4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)02时,转移电子的物质的量为 。K2Fe04与FeCl3相比,净水效果更好的是_ ,理由是 。
(4)高铁电池是一种新型可充电电池,总反应为:32n +2K2FeO4
+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式是:
。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式是:
。
29.(14分)I.飞机尾气中的NO会破坏臭氧层。利用催
化剂可使尾气中的NO和CO发生反应2NO +2CO
 2CO2:+N2;△H<0。已知增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积.对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中
2CO2:+N2;△H<0。已知增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积.对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中
|
实验编号 |
T(℃) |
NO初始浓度(mol/L) |
CO初始浓度(mol/L) |
催化剂的比表面积(m2/g) |
|
Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
Ⅱ |
|
1.20×10-3 |
|
124 |
|
Ⅲ |
350 |
|
5.80×10-3 |
|
 (1)请填全表中的各空格。
(1)请填全表中的各空格。
(2)请在右边给出的坐标图中,画出上表中的三
个实验条件下混合气体中NO浓度随时间变
化的趋势曲线图,并标明各条曲线的实验编号。
II.汽车内燃机工作时产生的高温会引起N2和O2的反应:
N2(g)+O2(g) =2NO(g)是导致汽车尾气
=2NO(g)是导致汽车尾气
中含有NO的原因之一。
2000C时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则该反应的平衡常数K=___ _ 。该温度下,若开始时向上述容器中充入1 molN2和一定量的O2,平衡时O2与NO的物质的量恰好相等,则平 衡时N2的物质的量是 。
28.(14分)镁及其合金是用途广泛的金属材料,目前世界上60%的镁是从海水中提取 的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下,回答下列问题:
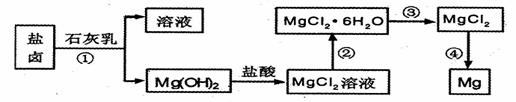
(1)从转化(①得到的Mg( OH)2沉淀中混有少量的Ca( OH)2,除去少量Ca( OH)2的方法是先将沉淀加入到盛有 的烧杯中,充分搅拌后经 __ __(填操作方法)可得纯净的Mg( OH)2,在此操作过程中,玻璃棒的作用是搅拌和 .
(2)写出转化④中发生反应的化学方程式___ _。
(3)已知转化③的反应原理与制取无水AlCl3相同下图是制取
 无水AlCl3实验装置图。装置A中的两液体分别是
无水AlCl3实验装置图。装置A中的两液体分别是
浓硫酸和浓盐酸。请回答:
①D为什么不直接加热来制取无水AlCl3,请用化学
方程式表示: ;
②分液漏斗中应盛装的试剂是__ __;
③由分液漏斗向烧瓶中加试剂时应注意的事项
是 。
15.在化学学习中使用数轴的表示方法可收到直观形象的效果,,下列表述中错误的是( )
A.分散质微粒的大小与分散系种类的关系:
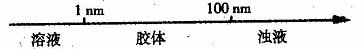
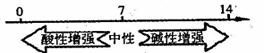
B.常温下,溶液的pH与其酸碱性的关系:
C.硫的化合物中化合价与硫元素氧化性、还原性的关系:
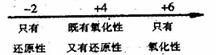
D.Fe在Cl2中燃烧的产物与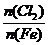 的关系:
的关系:
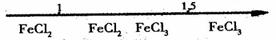
14.下列叙述正确的是 ( )
A.0.1 mol.L-lNH4Cl溶液:c(NH4+) =c(Cl一)
B.pH =4的盐酸与pH =10的氨水等体积混合后pH >7
C.0.1 mol.L一1与0.2mol.L一1氨水中c(OH一 )之比为1:2
D.中和pH与体积都相同的氨水和Ba( OH)2溶液,消耗HC1的物质的量之比是1:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com