
27.(9分)已知Fe3+的氧化性大于Cu2+,据此性质,某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。用离子方程式表示其化学原理___________________。
某实验小组的同学对该厂生产印刷电路后所得的废液进行了分析:取50.00 mL废液,向其中加入0.64 g金属铜,金属铜全部溶解;又取50.00 mL 废液,向其中加入足量的AgNO3溶液,析出沉淀43.05 g。请回答以下问题:
(1)该厂生产后废液中所含金属离子有________________________;
(2)该厂原来使用的FeCl3溶液的物质的量浓度________________(反应前后溶液的体积变化忽略不计);
(3)若向500.00 mL废液中加入足量的稀硝酸,在标准状况下生成NO气体4.48 L,则原废液中各金属阳离子的物质的量浓度之比为__________________;
(4)另取500.00 mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围为 ________ ___________。
余杭高级中学2009学年第一学期高三第二次月考
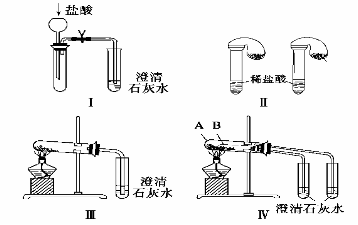
(2) 接着三、四小组用图Ⅲ、Ⅳ所示实验,均能鉴别这两种物质,但与实验Ⅲ相比,实验Ⅳ的优点是 (填选项序号)
A.Ⅳ比Ⅲ复杂 B.IV比Ⅲ安全
C.1V比Ⅲ操作简便 D.IV可以做到用同一套装置进行对比实验,而Ⅲ不行
(3) 若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中应装入的固体最好是 ;(填化学式)
(4) 某同学将质量为m1的NaHCO3 ,固体放在试管中加热片刻,冷却后测得剩余固体的质量为m2。试管中发生反应的化学方程式是______________;生成的Na2CO3 的质量为__________________。
(5)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当澄清石灰水过量时,其离子方程式为__________ _______。
②当碳酸氢钠与氢氧化钙物质的量之比为2:I时,所得溶液中溶质的化学式为____________,请设计实验检验所得溶液中溶质的阴离子____________。
26.(8分)海水的综合利用可以制备金属镁,其流程如下所示:
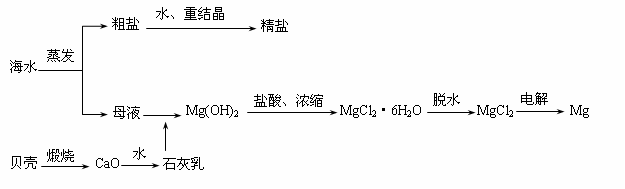
(1)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:____________ ___________________________。
过滤时:______________________ _________________。
蒸发时:_________________ _____________________。
(2)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式:(写一种即可)
________________________________________________________________________
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是___________ ________________。
(3)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?
写出实验步骤__________________ ______________
__。
五:计算题 (本题包含一个大题,共9分)
25.(10分)某校四个化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,分别用不同方法做了以下实验,如图I~~~Ⅳ所示。
24.(8分)如图所示,甲、乙、丙是三种常见单质,
X、Y、Z是常见化合物。它们之间有如下转化关系:
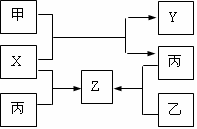
(1)若甲是短周期金属单质,乙、丙是短周期非金属
单质。甲与X在高温下反应且X、Y、Z中只有一种是离子晶体,试推断:
①含有丙元素的化合物是
(填X、Y、Z)
②X与甲反应的化学方程式
。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常状
况下是深红棕色液体,Y和Z具有相同的阳离子,试推断:
①写出乙、丙的化学式 。
②写出X与足量的甲在溶液中完全反应的离子方程式 。
四:实验题(本题包含两大题,共18分)
23.(8分)现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A、E同主族,A元素原子半径最小。B元素原子的最外层电子数是内层电子数的2倍。C元素最高价氧化物对应水化物X与其氢化物Y反应生成一种盐。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。试回答下列问题:
(1)写出D、E两元素形成的原子个数比为1:2的化合物的电子式
。
(2)写出Y与氯化铁溶液反应的离子方程式
.
(3)某盐由A、B、D、E四种元素组成,1 mol 该盐的质量为82 g。该盐水溶液呈 性,其原因是(用离子方程式表示)
。
(4)汽车尾气中含有B、C的氧化物,它们均为有害气体。在钯(Pd)等过渡金属的催化下,这两种气体可以相互反应转化为无害气体。请写出该转化的化学方程式
。
22.(9分)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子八种微粒(离子或分子)。请回答:
⑴A元素是 、B元素是
、C元素是
(用元素符号表示)。
⑵D是由两种元素组成的双原子分子,其分子式是 。
⑶E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。
⑷F是由两种元素组成的三原子分子,其分子式是 ,电子式是
。
⑸G分子中含有4个原子,其分子式是 。
⑹H分子中含有8个原子,其分子式是 。
21.(8分)为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验:
(1)若取ag样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为bL。反应的化学方程式是___________;样品中铝的质量是__________g。
(2)若取ag样品将其点燃,恰好完全反应,该反应的化学方程式是__________;氧化铁与铝的质量比是____________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为cL,该气体与(1)中所得气体的体积比c︰b=___________。
20.某溶液中只可能含有下列离子中的几种:K+、NO3-、SO42-、NH4+、CO32-(不考虑少量的H+与OH-),取200mL该溶液分成两等份,进行以下实验:

第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
第二份先加足量的盐酸无现象,再加足量的BaCl2,得到2.33g固体,则该溶液中 

A.可能含有K+
B.肯定含有NO3-、SO42-、NH4+、CO32-

C.一定不含有NO3- D.一定含有K+且c(K+)≥0.1mol/L 

19.根据中学化学教材所附元素周期表判断,下列说法中不正确的是 
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 
B.L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 
D.M层电子数奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
18.在FeCl3和CuCl2的混合液中,加入过量的Fe粉,若充分反应后溶液的质量没有改变,则原混合溶液中Fe3+和Cu2+的物质的量之比为 
A.14∶5
B.5∶14
C.7∶2
D.2∶7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com