
2.串联装置图比较
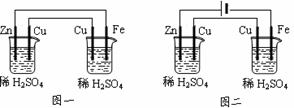
图一中无外接电源,两者必有一个装置是原电池装置(相当于发电装置),为电解装置提供电能,其中两个电极活动性差异大者为原电池装置,如图一中左图为原电池装置,右图为电解装置。图二中有外接电源,两烧杯均作电解池,且串联电解,通过的电流相等。
1.原电池装置与电解装置的比较--有无外接电源。
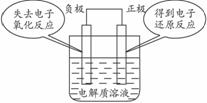
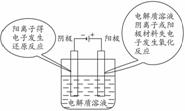
要注意到原电池的两极称为正负极,溶液中放电的阴离子向负极移动,放电的阳离子向正极移动,电解池的两极称为阴阳极,阴阳离子在外加电场的作用下分别向阳极和阴极移动。
5.原电池原理的应用
⑴利用原电池原理可以制造出各种实用电池,即化学电源,如锌锰干电池、铅蓄电池、锂电池、新型燃料电池等。
⑵原电池原理可用于解决一些实际问题,如加快某些化学反应时的速率(稀硫酸与锌反应时,常滴入几滴硫酸铜溶液);分析金属电化学腐蚀的快慢和防护方法等。
4.根据原电池的工作原理可得二次电池充电装置图为
 。
。
3.闭合回路的形成也有多种方式,可以是导线连接两个电极,也可以是两电极接触,如图2。
2.在原电池中,电极可能与电解质反应,也可能与电解质不反应,不发生反应的可看作金属发生吸氧腐蚀。如图1:
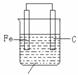
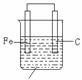
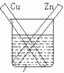
CuCl2溶液 NaCl溶液
图1 图2
1.常见的原电池有两类:一类是类似伏打电池的普通原电池装置;另一类是产生电流效率较高的带盐桥的原电池装置,如下图所示:
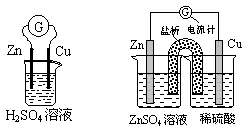
两装置工作原理是相同的,即总反应方程式是Zn+H2SO4=ZnSO4+H2↑。盐桥的作用是--使整个装置构成通路,代替两溶液直接接触;平衡电荷;提高电流效率。
5.氧化还原反应的基本规律
⑴守恒规律:电子得失总数(或化合价升降总数)相等。据此,可用于配平、计算。
⑵价态规律
①同种元素最高价态只具有氧化性;最低价态只具有还原性;中间价态既具有氧化性,又具有还原性。可简记为:高价氧,低价还,中价全。
②化合物(如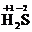 ):因既有正价又有负价,所以同时具有氧化性和还原性。
):因既有正价又有负价,所以同时具有氧化性和还原性。
⑶归中不交规律
①若价态相隔(即有中间价),一般能反应,且生成中间价态,但二者的化合价不会交叉变化。如
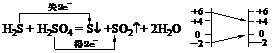
②若价态相邻,则不反应。如C-CO、CO-CO2、SO2-SO3等。
⑷先强后弱规律(反应顺序)
①一种氧化剂遇多种还原剂时,总是按还原性先强后弱的顺序反应。
例如,把Cl2通入FeBr2溶液中,Cl2可把Fe2+、Br-氧化,由于还原性Fe2+>Br-,所以Cl2先氧化Fe2+,之后,若还有Cl2,才氧化Br-。若n(FeBr2):n(Cl2) = 1:1,其离子方程式为:2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4Cl-
②同理,一种还原剂遇多种氧化剂时,是按氧化性先强后弱的顺序反应。
如Fe与CuCl2-HCl混合液,Fe先与Cu2+反应,后与H+反应。
⑸由强变弱规律(反应方向)
氧化还原反应总是向着氧化性和还原性减弱的方向进行,反之不能。据此,可判断两物质能否发生氧化还原反应。
4.氧化反应与还原反应的关系
氧化还原反应中,氧化反应与还原反应总是同时发生的。一个完整的氧化还原反应方程式可以拆写成两个“半反应”,一个是“氧化反应”,一个是“还原反应”。如2Fe3++Cu==2Fe2++Cu2+的拆写结果是:氧化反应为Cu-2e-==Cu2+;还原反应为2Fe3++2e-==2Fe3+,又如下表:
|
氧化还原反应 |
氧化反应 |
还原反应 |
|
3NO2+H2O==2H++2NO3-+NO |
2NO2-2e-+2H2O=4H++2NO3- |
2NO2+2e-+2H+=NO+H2O |
|
CH4+2O2+2OH-=CO32-+3H2O |
CH4+10OH--8e-=CO32-+7H2O |
2H2O+O2+4e-=4OH- |
3.氧化产物、还原产物的判断
氧化产物、还原产物是从实验得出的。对于一些我们不熟悉的氧化还原反应,可以根据化合价变化的规律,分析氧化产物、还原产物,如下表。
|
氧化剂 |
还原剂 |
氧化产物 |
还原产物 |
|
O3 |
I- |
不能确定 |
H2O |
|
Fe3+ |
SO2 |
SO42- |
Fe2+ |
|
MnO4- |
H2O2 |
O2 |
不能确定 |
|
ClO- |
Cl- |
Cl2 |
Cl2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com