
7.同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,两容器含有的( )
A.分子数和气体质量均不同 B.分子数和电子数均相同
C.质子数和中子数均相同 D.分子数、原子数和中子数均相同
6.判断下列有关化学基本概念的依据正确的是( )
A.溶液与胶体:本质不同的原因是能否发生丁达尔效应
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小
D.氧化还原反应:元素化合价是否变化
5.下列物质分类的正确组合是( )
|
|
碱 |
酸 |
盐 |
酸性氧化物 |
|
A |
纯碱 |
HNO3 |
小苏打 |
SO2 |
|
B |
烧碱 |
H2SO4 |
NaCl |
CO |
|
C |
苛性钠 |
CH3COOH |
石灰石 |
水 |
|
D |
熟石灰 |
H2CO3 |
苏打 |
SiO2 |
4.下列说法正确的是( )
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤浓HCl在与MnO2共热制取Cl2的实验中只起到还原剂的作用
A.①②③ B.③④ C.②③ D.③⑤
3.下列反应中水作为氧化剂的是( )
A.2F2+2H2O=4HF+O2↑ B.2Na2O2+2H2O=4NaOH+O2↑
C.3NO2+H2O=2HNO3+NO D.2Na+2H2O=2NaOH+H2↑
2.下列有关物质用途的说法中错误的是( )
A.钠钾合金在常温下呈液态,可以作为原子反应堆的导热剂
B.日常生活中无水乙醇常用于杀菌消毒
C.加碘盐是在食盐中加入一定量的碘酸钾,以确保人体对碘的摄入量,可预防甲状腺肿大
D.自来水厂常用氯气给自来水消毒
1.下列类型的反应,一定没有发生电子转移的是( )
A .化合反应 B.分解反应 C.置换反应 D.复分解反应
.化合反应 B.分解反应 C.置换反应 D.复分解反应
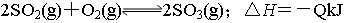
测得SO2的转化率为90%,则此条件下反应放出的热量(KJ)为:
A. 1.8Q B. 2Q C. Q D.
0.9Q
4. 有W、X、Y、Z四种金属,已知碱性X(OH)3>Y(OH)3,X3+可以氧化Z,W可与热水反应产生H2,X不能和热水反应,将X和Z金属丝相互缠绕,插入稀H2SO4中, X溶解速度加快,此四种金属活动性关系一定是
A. X>Y B. Z>Y
C. W>Z D.
Z>X
5. 下列各组离子,在pH=0的溶液中可以大量共存的是
A. Al3+、Fe3+ 、 Br-、SO32-
B. K+、Na+、SO42-
C. Na+、Cu2+、I-、NO3-
D. NH4+、K+、HPO42-、Cl-
二、选择题:(每小题4分,共28分,每小题有1-2个选项符题意,多选、错选均为0分,若正确选项包含2个,只选1个且正确给2分,)
6. AgCl的饱和溶液中,Cl-和Ag+物质的量浓度的乘积是个常数
,现把足量 AgCl放到下列物质中:
①20mL0.1mol·L-1的(NH4)2CO3溶液 ②40mL0.02mol·L-1的CaCl2溶液,
③30mL0.03mol·L-1的NaCl溶液 ④10mL蒸馏水
⑤50mL0.05mol·L-1AgNO3溶液。
则 AgCl的溶解度由大→小排列的顺序是:
A. ①②③④⑤ B. ①④③②⑤ C. ⑤④②①③ D. ④③⑤②①
7. 把100g浓度为18mol·L-1、密度为1.84g·cm-3浓H2SO4加入到一定量的水中稀释成9mol·L-1的H2SO4,则加入水的体积为:
A. <100mL B. 100mL C. >100mL D.
100/1.84mL
8. 有m1gKCl饱和溶液,其质量分数为C1%;采取某措施后析出ngKCl(不含结晶水),滤液质量为m2g,质量分数为C2% 。下列关系错误的是
A. m1≥m2+n B. m1
C1-m2 C2=100n
C. C1一定大于C2 D. 原条件下KCl的溶解度一定大于C1 g
9. Na2O2 , CaC2 ,CaH2
, Mg3N2都能与H2O反应且反应中都气体放出。下列说法正确的是:
A. 都属于氧化还原反应
B. CaC2,Mg3N2与水的反应属于复分解反应
C. Na2O2、CaH2与H2O反应时水作氧化剂
D. CaH2与H2O反应时产生H2,H2是氧化产物和还原产物
10.已知铋酸钠(NaBiO3)在酸性条件下可以将Mn2+氧化为MnO4-。下列可用于酸化NaBiO3的溶液的是:
A. HNO3
B. HCl C. H2SO4 D. H2S
11.某单质能与足量的浓HNO3反应放出NO2气体,若参加反应的单质和HNO3的物质的量之比为1:a,则该 单质元素在反应后所显示的化合价是
A. +2a B. +a C. +a/2 D. +a/4
12.下列反应的离子方程式正确的是.
A. 用惰性电极电解CuSO4溶液,2Cu2++2SO42-+2H2O 2Cu+O2↑+2H2SO4
B. 在Al2(SO4)3溶液中加入NaAlO2溶液,Al3++3AlO2-+6H2O=4Al(OH)3↓
C. 在酸性KMnO4溶液中滴加H2O2后产生气体:H2O2+2MnO4-+6H+=2Mn2++3O2↑+4H2O
D. Mg与浓NH4Cl溶液共热:Mg+2NH4+
2Cu+O2↑+2H2SO4
B. 在Al2(SO4)3溶液中加入NaAlO2溶液,Al3++3AlO2-+6H2O=4Al(OH)3↓
C. 在酸性KMnO4溶液中滴加H2O2后产生气体:H2O2+2MnO4-+6H+=2Mn2++3O2↑+4H2O
D. Mg与浓NH4Cl溶液共热:Mg+2NH4+ 2NH3↑+Mg2++H2↑
2NH3↑+Mg2++H2↑
第II卷 主观题(共52分)
13.(8分)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连硫酸铵)溶液则发生如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+ ,该反应常用于检验Mn2+的存在,其特征现象是 ,若反应中有0.1mol还原剂参加反应,则消耗氧化剂的物质的量为 。 14.(8分)已知反应2FeCl3+2KI=2FeCl2+2KCl+I2 ,现在FeI2溶液中通入一定量的Cl2,使一半的Fe2+被氧化,试与出反应的化学方程式 。 15.(6分)在下列反应中:11P+15CuSO4+24H2O=5Cu3P↓+6H3PO4+15H2SO4中,1mol Cu2+能氧化P的物质的量为___________。 16.(5分)某温度下饱和CuSO4溶液的溶质的质量分数是p%,向其中加入ag无水CuSO4,温度不变,最后析出bg CuSO4· xH2O晶体(b>a),写出p%、a、b、x的关系式___________。 17.(15分)已知RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,有0.2molRxO42-离子参加反应时,共转移0.4mol电子 (1)反应的氧化产物为___________;(2)x=___________;(3)参加反应的H+的物质的量为___________ 18.(10分)30℃时,将8.0g饱和CuSO4溶液加水稀释至100mL,取出10mL,加入过量KI溶液,发生如下反应: 2Cu2++4I-=2CuI↓+I2 反应所生成的I2能把20mL、0.05mol·L-1的Na2S2O3中的S2O32-全部氧化成S4O62-,方程式为: I2+2S2O32-=2I-+S4O62- 求:30℃时CuSO4的溶解度。
3、
 实验步骤:
实验步骤:

 组装仪器 →
检查装置的气密性 → 装药品 → 收集气体
组装仪器 →
检查装置的气密性 → 装药品 → 收集气体

 特点:一变两不变
特点:一变两不变

2、
 仪器装置:发生装置: 固液反应不需加热
仪器装置:发生装置: 固液反应不需加热

 收集方法:排水集气法、向上排空气法
收集方法:排水集气法、向上排空气法
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com