
20.(共8分)在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:
CO(g) + H2O(g) 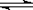 CO2 + H2(g) ΔH< 0
CO2 + H2(g) ΔH< 0
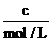 已知CO的浓度变化如图所示。
已知CO的浓度变化如图所示。

(1)从0~4 min,该反应的平均速率v(CO)= mol/(L·min)。该反应的平衡常数为 。
(2)为了增大CO的转化率,可以采取的措施有 。
|
a.增大反应物中CO的浓度 |
b.降低反应温度 |
|
c.将密闭容器体积压缩至一半 |
d.加入适宜的催化剂 |
(3)若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为 。
19. (共6分)在400 ℃、101 kPa时,NO2(g)+CO(g) NO(g) + CO2(g)反应过程的能量变化如下图所示。
(共6分)在400 ℃、101 kPa时,NO2(g)+CO(g) NO(g) + CO2(g)反应过程的能量变化如下图所示。
|
|
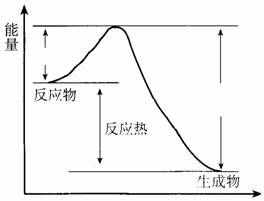
反应过程
(1)该反应是 (填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为
。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是 。
|
a.浓度 |
b.压强 |
|
c.温度 |
d.催化剂 |
18.(共6分)短周期元素X、Y、Z、W原子序数依次增大。X是形成化合物种类最多的元素,Y是自然界含量最多的元素,Z是同周期中金属性最强的元素,W的负一价离子与Y的某种氢化物分子含有相同的电子数。
(1)元素X、Y、Z按原子半径由大到小的顺序排列为 。
(用元素符号表示)。
(2)W的单质与水反应的离子方程式为
。
(3)化合物A由X、Y、Z三元素共同构成,其浓溶液中通入W的单质时,可产生气体XY2和化合物ZWY3。反应的化学方程式为
。
17.(共6分)A、B、C是中学化学常见物质,含有同一种元素。其转化关系如下:

(1)若X为无色无味的气体,是一种常用氧化剂。A为气体化合物,溶于水后所得溶液使红色石蕊试纸呈蓝色。该转化关系是工业制硝酸的反应原理。
则A的电子式是 。
(2)若X为还原剂。将5~6滴A的饱和溶液滴入沸水中,可得到红褐色液体,该液体能产生丁达尔效应。反应②的离子方程式为
。
(3)若X为一种常见的碱,A、C均为盐,B为白色胶状沉淀,几乎不溶于水,但能凝聚水中的悬浮物。已知Na2S溶液显碱性,向A的溶液中加入Na2S溶液,生成具有臭鸡蛋气味的气体H2S,反应的离子方程式为
。
16.(共10分)某校实验小组进行实验研究(实验装置示意图如下)。
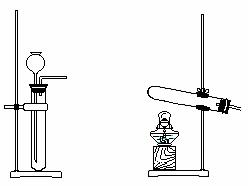
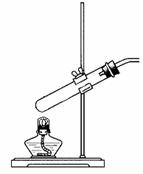
a. b. c.
(1)制取氧气可选用的发生装置是 (填字母序号)。该小组用制取的氧气进行硫在氧气中燃烧的性质实验时,在集气瓶底加入了少量氢氧化钠溶液。盛放该溶液的目的是 。
(2)①该小组用装置b制得NH3。其反应的化学方程式为
。
②该小组用装置b进行铁和水蒸气的反应,其化学方程式为
。
(3)该小组用装置c可进行的实验有 (写出一个即可)。
15.(共8分)中药秦皮中含有的七叶内酯属于香豆素类,具有显著的消炎作用,是抗痢疾杆菌的有效成分。其结构简式如下:

(1)七叶内酯的含氧官能团的结构简式为 。
(2)七叶内酯可以发生的反应类型有 (填序号)。
a.加成反应 b.取代反应 c.消去反应
(3)香豆素类物质常被看做是肉桂酸的衍生物。工业上可用物质A制备肉桂酸和肉桂醇。反应关系如下:
|
|
|


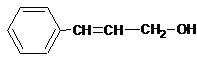
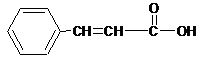
肉桂醇 肉桂酸
A的结构简式为 。
(4)七叶内酯与足量氢氧化钠稀溶液充分反应。化学方程式为
。
14.100 mL 0.1 mol / L的盐酸与50 mL 0.2 mol / L的氨水混合,充分反应后,所得溶液中各种离子浓度关系正确的是 A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)=c(NH4+ )>c(OH-)=c(H+)
C.c(H+)+c(NH4+ )=c(Cl-) +c(OH-) D.c(H+)+c(Cl-)=c(NH4+)+c(NH3·H2O)+c(OH-)
海淀区高三年级第一学期期中练习
化 学 2009.11
请将第Ⅰ卷中各小题答案前的字母,填写到下表中相应的位置上。
第Ⅱ卷(非选择题,共58分)
13.Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3=Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
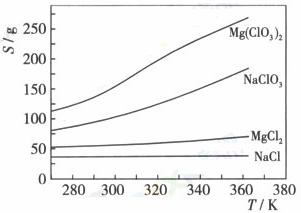
下列叙述正确的是
A.四种化合物的溶解度随温度变化最小的是Mg(ClO3)2
B.300 K时,MgCl2的溶解度约为55 g
C.300 K时,100 g NaCl饱和溶液中约含有NaCl 36g
D.该反应能够进行的条件是生成沉淀,该沉淀是Mg(ClO3)2
12.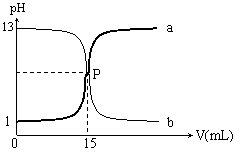 右图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是
右图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是
A.盐酸的物质的量浓度为1 mol/L
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用做本实验的指示剂
11.下列反应的离子方程式正确的是
A.硫酸镁溶液跟氢氧化钡溶液反应: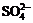 +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
B.稀硫酸滴在铜片上: Cu+2H+=Cu2++H2↑
C.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl-
D.食醋除水垢中的碳酸钙:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com