
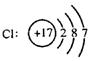
类似可以表示简单离子结构示意图。 (6)分子式(化学式): CO2,C6H12O6,C2H4O2,Ca(NO3)2 (7)结构式: 表示物质内部结构中各元素原子的排列和结合方式的化学式。其中,用“-”表示一对共用电子对。如:
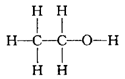
(8)结构简式:
CH3-CH2-OH或CH3CH2OH或C2H5OH
㈡化合价
化合价:
一种元素一定数目的原子跟其他元素一定数目的原子化合的性质,叫做这种元素的化合价。
(1)化合价有正价和负价。
(2)化合价的本质:
①在离子化合物中,失去电子的为正价,失去几个电子即为正几价;得到电子的为负价,得到几个电子即为负几价。
②在共价化合物中,元素化合价的数值,就是这种元素的一个原子跟其他元素的原子形成的共用电子对的数目,正负价则由共用电子对的偏移来决定,电子对偏向哪种原子(该原子呈负电性),哪种原子就显负价。偏离哪种原子,哪种原子就显正价。
例1:
NaCl,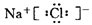 ,故钠为+1价,氯为-1价
Na2O,
,故钠为+1价,氯为-1价
Na2O, ,故Na为+1价,氧为-2价
FeS2,
,故Na为+1价,氧为-2价
FeS2,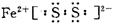 ,Fe为+2价,硫为-1价
例2:
HCl,
,Fe为+2价,硫为-1价
例2:
HCl,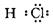 共用电子对偏向氯原子,所以H为+1价,Cl为-1价CO2,
共用电子对偏向氯原子,所以H为+1价,Cl为-1价CO2,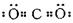 ,每个C原子与2个O原子共用4对电子,共用电子对偏向氧,故C为+4价,而O为-2价。
(3)原子团的化合价:
如SO42-,CO32-为-2价,HCO3-,HS-,H2PO4-为-1价,PO43-为-3价。
(4)化合价是元素化合时所表现出来的性质,所以单质中元素的化合价为零。
(5)化合价的表示方法:
在元素的正上方以+m、-n 表示 (注意:与电荷数表示法的区别Ca2+,SO42-)
,每个C原子与2个O原子共用4对电子,共用电子对偏向氧,故C为+4价,而O为-2价。
(3)原子团的化合价:
如SO42-,CO32-为-2价,HCO3-,HS-,H2PO4-为-1价,PO43-为-3价。
(4)化合价是元素化合时所表现出来的性质,所以单质中元素的化合价为零。
(5)化合价的表示方法:
在元素的正上方以+m、-n 表示 (注意:与电荷数表示法的区别Ca2+,SO42-)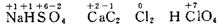 (6)同种元素可表现出多种化合价,称为变价元素,主要是某些非金属元素和过渡金属。
例:
(6)同种元素可表现出多种化合价,称为变价元素,主要是某些非金属元素和过渡金属。
例:
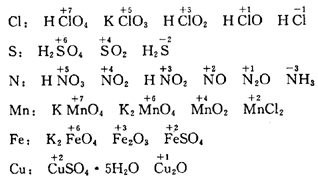
(7)化合价与化学式,在化学式中各元素正负化合价代数和为零。
如: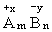 ,则mx+n·(-y)=0, mx=ny
,则mx+n·(-y)=0, mx=ny
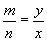 即化学式中的原子个数比=化合价的反比。
(8)化学反应与化合价。
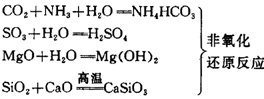
在化学反应中,若所有元素的化合价都没有变化,称为非氧化还原反应,反应原则为“等价交换”,即:正价与正价交换,负价与负价交换,且交换的化合价总数相同,每种物质都呈电中性;若有化合价升降,则称为氧化还原反应,反应原则为“化合价升高的总数=化合价降低的总数”。
(9)常见元素化合价表
K,Na,Ag +1
H +1,-1
Ca,Mg,Ba,Zn +2
F -1
Cu +1,+2 Cl -1,+1,+5,+7
Fe +2,+3 O -2,-1
Al +3 S -2,+4,+6
Mn +2,+4,+6,+7 Si +4
P -3,+3,+5 B +3
As -3,+3,+5 N -3,+1,+2,+3,+4,+5
㈢化学方程式
1、化学反应的分类
即化学式中的原子个数比=化合价的反比。
(8)化学反应与化合价。
在化学反应中,若所有元素的化合价都没有变化,称为非氧化还原反应,反应原则为“等价交换”,即:正价与正价交换,负价与负价交换,且交换的化合价总数相同,每种物质都呈电中性;若有化合价升降,则称为氧化还原反应,反应原则为“化合价升高的总数=化合价降低的总数”。
(9)常见元素化合价表
K,Na,Ag +1
H +1,-1
Ca,Mg,Ba,Zn +2
F -1
Cu +1,+2 Cl -1,+1,+5,+7
Fe +2,+3 O -2,-1
Al +3 S -2,+4,+6
Mn +2,+4,+6,+7 Si +4
P -3,+3,+5 B +3
As -3,+3,+5 N -3,+1,+2,+3,+4,+5
㈢化学方程式
1、化学反应的分类

2、化学方程式:
用化学式来表示化学反应的式子,叫做化学方程式。如:

化学方程式主要包括:
⑴普通化学方程式,⑵热化学方程式,⑶离子方程式,⑷电离方程式,⑸电极反应式,⑹电解方程式,⑺络合方程式等。
■注意:
书写化学方程式要遵守两个原则:
一是必须以客观事实为基础,不可臆造;二是要遵守质量守恒定律,即要配平。
3、各类化学方程式介绍
⑴热化学方程式:
表明反应所放出或吸收的热量的化学方程式。
在书写热化学方程式时要:
①注明反应的温度和压强(在101kPa、25℃条件可省略);
②注明反应物与生成物的状态(s、l、g);
③用△H
标明反应热,“+”表示吸热,“-”表示放热;热化学方程式中化学计量数只表示物质的量,所以可以为分数;计量数与反应热正比。如:
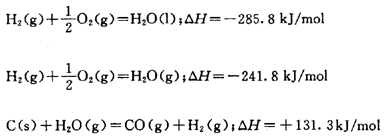
⑵离子方程式:
用实际参加反应的离子符号来表示离子反应的式子叫做离子方程式。
NaOH+HCl:OH-+H+=H2O
CaCO3+HNO3:CaCO3+2H+=Ca2++CO2↑+H2O
FeCl3+NaOH:Fe3++3OH-=Fe(OH)3↓
Cl2+NaOH:Cl2+2OH-=Cl-+ClO-+H2O
■注意:
①易溶于水、易电离的强电解质写成离子,其他,如单质、气体、弱电解质、一般氧化物、不溶于水的物质应保留化学式。
②配平时除遵守质量守恒定律外,还要使电荷平衡;对于氧化还原反应,还要保证得失电子总数相等。如:
Fe2++Cl2=Fe3++2Cl-(错误)
2Fe2++Cl2=2Fe3++2Cl-(正确)
⑶电离方程式:
表示电解质在溶液中或熔化状态下电离产生相应自由离子的过程。此过程不是化学反应,所以它不属于离子反应方程式。
①强电解质的电离:完全电离,用“=”
NaNO3=Na++NO3-
H2SO4=2H++SO42-
Ba(OH)2=Ba2++2OH-
②弱电解质的电离:部分电离,用“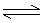 ”
”
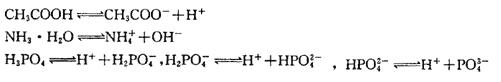
⑷水解方程式:
详见下面的水解反应
⑸电极反应式:
表示原电池反应、电解反应时电极上所发生反应的方程式,一对电极反应才能表达一个完整的化学反应。
①Cu-Zn-稀H2SO4原电池
负极(Zn):Zn-2e-=Zn2+
正极(Cu):2H++2e-=H2↑
②以石墨电极电解饱和食盐水
阳极:2Cl--2e-=Cl2↑
阴极:2H2O+2e-=H2↑+2OH-
⑹电解方程式:
如电解饱和食盐水2NaCl+2H2O 2NaOH+H2↑+Cl2↑
4、各类反应介绍
⑴化合反应
两种或两种以上的物质作用,生成一种物质的反应叫做化合反应。化合反应可以是氧化还原反应,也可是非氧化还原反应。
2NaOH+H2↑+Cl2↑
4、各类反应介绍
⑴化合反应
两种或两种以上的物质作用,生成一种物质的反应叫做化合反应。化合反应可以是氧化还原反应,也可是非氧化还原反应。
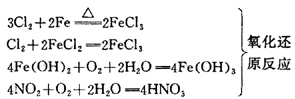
⑵分解反应
一种物质经过反应后生成两种或两种以上物质的反应。它是与化合反应相对应的反应类型,很多化合反应的逆过程就是分解反应,也能在一定条件下发生。
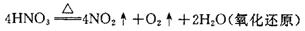
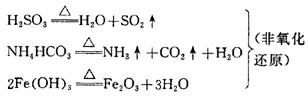
⑶复分解反应
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。复分解反应都不是氧化还原反应。中学所讲的复分解反应一般是指在水溶液中进行的离子间的交换(但不绝对)。如:
①中和反应:酸十碱→盐十水
H2SO4+2NaOH=Na2SO4+2H2O
Al(OH)3+NaOH=NaAlO2+2H2O
3HCl+Fe(OH)3=FeCl3+3H2O
②其他复分解反应
Na2O+H2SO4=Na2SO4+H2O
CuO+H2SO4=CuSO4+H2O
SO2+2NaOH=Na2SO4+H2O
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
2HCl+CaCO3=CaCl2+CO2↑+H2O
NaCl(固)+H2SO4(浓)=NaHSO4+HCl↑
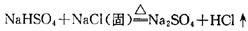 BaCl2+Na2SO4=BaSO4↓+2NaCl
⑷水解反应
一般规律:
BaCl2+Na2SO4=BaSO4↓+2NaCl
⑷水解反应
一般规律: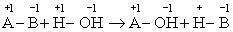 。当然,其他化合价形式类似。
类型:盐水解、其他无机物的水解、卤代烃水解、酯水解、糖水解、蛋白质水解等。
。当然,其他化合价形式类似。
类型:盐水解、其他无机物的水解、卤代烃水解、酯水解、糖水解、蛋白质水解等。
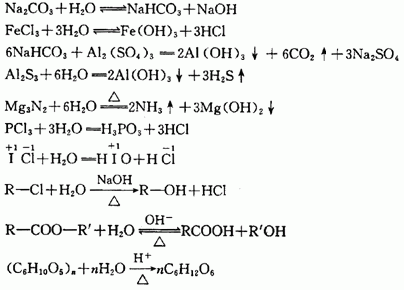
⑸置换反应
一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应。置换反应都是氧化还原反应。置换反应共有4类:
①金属置换非金属(干态或水溶液中进行)
Fe+H2SO4(稀)=FeSO4+H2↑
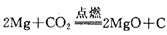 ②金属置换金属(干态或水溶液中进行)
Fe十CuSO4=Cu十FeSO4
②金属置换金属(干态或水溶液中进行)
Fe十CuSO4=Cu十FeSO4
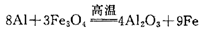 ③非金属置换非金属(干态或水溶液中进行)
Cl2十2NaBr=2NaCl十Br2
2F2十2H2O=4HF十O2↑
③非金属置换非金属(干态或水溶液中进行)
Cl2十2NaBr=2NaCl十Br2
2F2十2H2O=4HF十O2↑
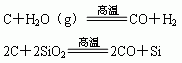
④非金属置换金属(只能在水溶液中进行)
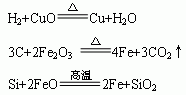
⑹氧化还原反应(详细讲解见《氧化还原反应》专题)
有电子转移的(或化合价升降的)反应叫做氧化还原反应,是一种重要的反应类型,也是学习化学反应的难点。
①氧化还原反应的本质:失得电子,且失电子总数等于得电子总数
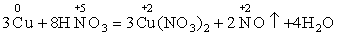 Cu失电子数:3×(2-0)=6
HNO3得电子数:2×(5-2)=6
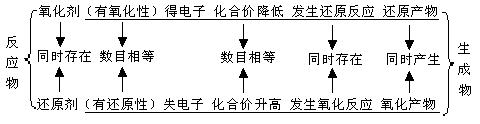
②有关概念之间的关系
Cu失电子数:3×(2-0)=6
HNO3得电子数:2×(5-2)=6
②有关概念之间的关系
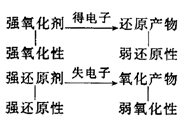
③氧化性、还原性强弱比较
④常见的氧化剂和还原剂 强氧化剂:KMnO4,K2Cr2O7,浓H2SO4,HNO3,Ca(ClO)2,H2O2,Na2O2,Cl2,Br2,O2等。 强还原剂:活泼金属如Na,Mg,Al等,H2S,S2-,SO2,SO32-,H2SO3,I-,HI,Fe2+等。 ⑺离子反应(详细内容见《离子反应专题》专题) 有离子参与的化学反应(包括有离子参加或生成的反应)。电解质在水溶液中进行的反应都是离子反应。 ①离子反应的本质:消耗反应物的离子、使反应物的离子浓度降低。 ②离子反应的条件:消耗反应物的离子,生成了难电离、难溶或挥发性物质。 ③离子反应的表达:离子方程式
实验室需用100 g 20%的硝酸钾溶液,现提供如图2所示的足量药品,仔细观察,认真设计,将配制溶液的方案及所需的各种药品用量填入下表中:
方案
药品用量
方案一:将10%的硝酸钾溶液蒸发水分。
需10%的硝酸钾溶液 g
方案二:
通过这节课的学习,我的收获有……
2、在解题中要注意:
①设未知数时要指明质量,不带单位;
②计算过程中的质量单位该带的必须带上,不能遗漏。
例:把100 g 10%的食盐溶液稀释成5%,需加水多少克?
分析:向溶液中加水稀释的过程中溶质的质量不变。
解:设需要加水的质量为x
100 g×10%=(100 g + x)×5%
解得:x=100 g
答:需加100g水。
[学以致用]现有100 g 溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数增加一倍,应蒸发掉水 g。请写出你的计算过程。
[教你一招]
[友情提示]
对于较复杂的关于溶液的计算题,若不能直接利用公式得出结果,此时可以用设未知数的方法来解决。
1、解较复杂的关于溶液的计算题的一般思路可概括为:解、设、列、算、答。
2、[走进生活]禽流感期间,某养殖户需配制200 g 20%的氢氧化钠溶液对禽舍用具进行杀菌消毒。
(1)配制时需称取氢氧化钠固体 g,水 mL。
(2)配制此溶液的步骤为 、 和 ;配制过程中用到的仪器有 药匙和胶头滴管。
(3)用质量为23.1 g 的烧杯为容器,在托盘天平上称取所需的氢氧化钠固体时,请在下表中选出所需的砝码(打“√”表示选用),并在图1中用 画出游码的位置。
画出游码的位置。
砝码大小/g
100
50
20
20
10
5
打“√”表示选用
1、[我们合作,我们设计,我们实验]
实验内容:与同学合作配制50 g 16%的食盐溶液。
实验仪器和药品:托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒、足量的蒸馏水和食盐固体。
实验流程图示
请你设计:
(1)计算:食盐固体需 g;蒸馏水需 g,换算成体积需 mL。
(2)称量:用 称量所需的食盐,倒入烧杯中;用 量取所需的水,倒入烧杯中。(温馨小贴士:注意称量固体物质和量取液体的正确方法。)
(3)溶解:用 搅拌使食盐完全溶解。(温馨小贴士:注意搅拌的正确方法。)
(4)装瓶存放:把配制好的溶液装入试剂瓶中,盖好瓶塞,贴上标签(注明药品名称和溶质的质量分数)。
7、[走进生活]溶质的质量分数为5%-50%的葡萄糖溶液可以作为注射营养液,若用10 g葡萄糖配制10%的葡萄糖溶液,需加入水 g。
6、[学以致用]实验室要配制溶质质量分数为15%的氢氧化钠溶液200 g;需要氢氧化钠固体 g,水 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com