
2、(必修5 p44 6(4))在等差数列中,已知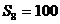 ,
,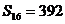 ,则
,则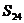 =
.
=
.
1、(必修5 p71,6)已知不等式 >0的解集是
>0的解集是
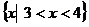 , 则实数a= ,b 。
, 则实数a= ,b 。
7.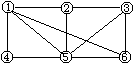 如右图所示,6个编号分别代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应(已知高温下氨气能还原氧化铁)。a.Al b.Fe2O3
c.NaOH溶液 d.氢碘酸溶液 e.NH3
f.Cl2,图中⑤表示的物质是
如右图所示,6个编号分别代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应(已知高温下氨气能还原氧化铁)。a.Al b.Fe2O3
c.NaOH溶液 d.氢碘酸溶液 e.NH3
f.Cl2,图中⑤表示的物质是
A.a或b B.c C.d D.e或f
6. 下列有关分散系中几个基本概念的分析,其中正确的是
A.若A中混有少量的B,可采用冷却热饱和溶液法提纯A
|
温度 |
20℃ |
50℃ |
|
A的溶解度 |
35.7g |
46.4g |
|
B的溶解度 |
31.6g |
108g |
B.上述两种盐在相同温度下配制的饱和溶液的浓度不可能相同
C.氯化钠溶液、水等分散系不能发生丁达尔现象
D.在Fe(OH)3胶体中滴加入少量H2SO4将有沉淀产生
5. 下列叙述正确的是
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
4. 下列条件下,两种气体的分子数一定不相等的是
A.相同质量、不同密度的N2O和CO2
B.相同体积、相同密度的CO和C2H4
C.相同温度、相同压强、相同体积的O2和O3
D.相同压强、相同体积、相同质量的NO2和N2O4
3. 用NA表示阿伏加德罗常数,以下各说法中正确的是
A.常温常压下,11.2 L氯气含有的分子数目大于0.5NA
B.常温常压下,2.24 L四氯化碳中所含氯原子数大于0.4 NA
C.0.1mol的铜与足量的浓硫酸反应生成SO2的体积约为22.4L
D.在同温同压下,相同体积的任何气体单质应含有相同的原子数
2. 下列说法中不正确的是
A.-NO2和NO2所含有的电子总数不相等
B.-OH和  的化学性质相同
的化学性质相同
C.HCOOCH3和CH3OCHO是同一物质
D.若CH3+中所有的原子共平面,则其键角为120°
1. 下列各项表达式正确的是
下列各项表达式正确的是
A.乙炔的分子模型示意图:
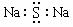 B.Na2S的电子式:
B.Na2S的电子式:
C.NH4Cl的电子式: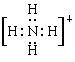 Cl-
Cl-
D.水的电离方程式:H2O+H2O H3O+
+OH-
H3O+
+OH-
6.理想气体状态方程
pV = nRT =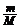 RT RT |
→ |
pM =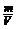 RT = RT RT = RT |
其中R为常数,当p以千帕为单位时,R=8.314 J/(mol·K)。
由理想气体状态方程可得出下列推论:
①物质的量n相同时: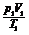 =
=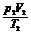
②标准状况时,1 mol任何气体的体积为:V = 22.4 L(即气体摩尔体积)。
③同温、同压: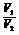 =
=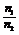 =
=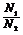 (即阿伏加德罗定律)
(即阿伏加德罗定律)
④同温、同体积: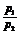 =
=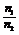 =
=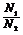
⑤同温、同压: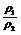 =
=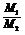 = D(相对密度)
= D(相对密度)
⑥同温、同压、同体积: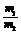 =
=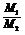
⑦同温、同压、同质量: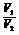 =
=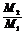
⑧同温、同压、同质量: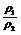 =
=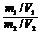 =
=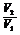
[思想方法]
[例1]化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.CO2的电子式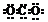 B.Cl-的结构示意图
B.Cl-的结构示意图
C.乙烯的结构简式C2H4 D.质量数为37的氯原子 Cl
Cl
[分析]从命题趋势上看,由于综合考试中受题量的限制,故知识覆盖面不可能达到面面俱到,只能是把一些学科的要点知识通过渗透、合并、综合、嫁接、关联进行考查。从备考角度讲,这些内容不算难点,主要是通过训练熟练各“式”“符号”的写法和意义,能判断出题给“式”“符号”是否正确?为什么错了?应如何改正?书写的规律是什么?CO2正确电子式应为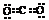 。C项所写的是乙烯的分子式,正确的结构简式为CH2═CH2。质量数为37的氯原子应表示为
。C项所写的是乙烯的分子式,正确的结构简式为CH2═CH2。质量数为37的氯原子应表示为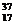 Cl。本题应选B。
Cl。本题应选B。
 [例2]设NA表示阿伏加德罗常数,下列说法正确的是
[例2]设NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下1molHCl与HF的混合物的体积约为22.4L
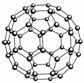
B.N60结构如右图,28gN60单质中含有的N-N键个数为NA
C.1.72g生石膏(CaSO4·2H2O) 转化为熟石膏(2CaSO4·H2O) 失
去的结晶水数目为0.015NA
D.9 g重水所含有的电子数为5NA
[分析]阿伏加德罗常数正误判断题在注重对有关计算关系考查的同时,又隐含对某些概念理解的考查。试题计算虽然难度不大,但概念性强,区分度大,是每年高考的必考试题。选项A中,由于HF分子中存在氢键,在标准状况下呈液态,因此1molHCl与HF的混合物的体积应小于22.4L。选项B中,N60分子中所含N-N键的数目为60×3/2=90,因此28gN60单质中含有的N-N键个数为28×90/(14×60)=3NA。选项C中生石膏转化为熟石膏的化学方程式为:2[CaSO4·2H2O]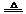 2CaSO4·H2O+3H2O,因此共失水0.015NA。9g重水的物质的量为
2CaSO4·H2O+3H2O,因此共失水0.015NA。9g重水的物质的量为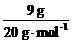 =0.45 mol,其含有电子数为4.5NA。本题应选C。
=0.45 mol,其含有电子数为4.5NA。本题应选C。
[例3]阿伏加德罗常数(NA)、物质的量(n)和粒子数(N)之间有如下关系:NA=N/n,测定阿伏加德罗常数有多种方法,其中电解法是常用的方法。实验室有同样浓度的KCl、CuCl2、AgNO3、H2SO4等溶液,若实验过程中不考虑电极上的析出物与电解后的溶液之间的反应,则你认为选用哪一种溶液作为电解液,实验既简便、测定结果误差又小。
A.KCl B.CuCl2 C.AgNO3 D.H2SO4
[分析]本题以电解原理为命题切入点,综合考查了《考试大纲》中强调的对电解原理、阿伏加德罗常数的掌握。①若电解KCl、H2SO4溶液,产生的气体体积较难测定准确。②同样条件,通过等量的电量,析出的Ag的质量大于Cu,因而称量和计算时产生的误差前者要小,因此选用AgNO3来得更合适。本题应选C。
[例4]将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液。下列说法中正确的是
A.若c1 = 2c2,则w1<2w2,V<50 mL B.若c1 = 2c2,则w1<2w2,V>50 mL
C.若w1 = 2w2,则c1<2c2,V=50 mL D.若w1 = 2w2,则c1>2c2,V<50 mL
[分析]本题主要考查浓度的计算与换算,此考点也是化学常用计量中的热门考点。设溶液的体积为V L,密度为ρ g·mL-1,溶质的摩尔质量为M g·mol-1,质量分数为w,物质的量浓度为c mol·L-1,则根据溶液浓度表达方式不同,但其溶质不变有: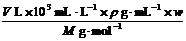 =V L·c mol·L-1,即c=
=V L·c mol·L-1,即c=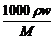 。若w1 = 2w2,
。若w1 = 2w2, =
=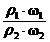 =2·
=2·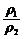 ,由于ρ2<ρ1,所以c1>2c2。稀释后质量分数减半,说明浓硫酸与水等质量混合,水的密度可认为是1g/cm3,因此V值等于50mL。若c1 = 2c2,
,由于ρ2<ρ1,所以c1>2c2。稀释后质量分数减半,说明浓硫酸与水等质量混合,水的密度可认为是1g/cm3,因此V值等于50mL。若c1 = 2c2,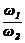 =
=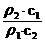 =2
=2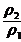 ,由于ρ2<ρ1,所以w1<2w2,同时可知V<50 mL。本题应选A。
,由于ρ2<ρ1,所以w1<2w2,同时可知V<50 mL。本题应选A。
[专题演练]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com