
4.说说文章最后一句中“地球绝不仅仅是人类的家园”的言外之意。
要丑的不要帅的
姜钦峰
谈判专家,想必没有人会陌生,在警匪片中,时常能见到他们的飒爽英姿。谈判专家总是在最危急的时刻现身,当绑匪挟持人质与警察对峙,剑拔弩张之时,谈判专家上来一番促膝长谈,往往能让穷凶极恶的歹徒土崩瓦解,缴械投降。
在处理突发事件时,谈判专家往往能收到奇效,兵不血刃地化解危机,成本低,效益高。因此,各国警方都把谈判专家当作处理人质危机的一张王牌。但这也是最危险的工作,谈判专家只能赤手空拳地面对歹徒,不能穿制服,不能携带任何攻击性武器或防御装备,比如手枪,防弹背心、防刺手套,等等,要想保证自身和人质的安全,全凭一张嘴。可想而知,要想成为一名合格的谈判专家绝非易事,选拔标准极为苛刻。
北京警察学院教授高锋,被誉为中国第一谈判专家,也是国内谈判专家总教头。他在选择谈判专家学员时,有极其严格的“四项基本原则”:年龄在三十五到四十六岁之间;智商在120以上;布鲁卡区(语言中枢)发达;社会民俗经验丰富,知识面广泛。所谓“知识面广泛”,至少包括14个学科知识:政治、金融、外交、哲学、民族、宗教、语言、心理、生理、爆炸、表演、计算、气象、社会学。
除此之外,学员的外表长相,也是至关重要的选拔标准。在影视作品当中,我们见到的谈判专家,个个都是高大威猛、英气逼人的大帅哥。然而实际上恰恰相反,对于学员外表的选择,高锋教授同样有三大原则:要丑的不要帅的,要胖的不要瘦的,要矮的不要高的。或许有人会说,这哪是选拔精英,倒有点像武大郎开店。为何有这种奇怪的标准呢?
高锋教授解释说:当谈判专家接近歹徒时,歹徒突然发现,来人其貌不扬,会下意识地产生愉悦感,获得心理优势,心想此人也不过如此,长得还不如我呢,自然放松了警惕;而且胖人和矮人看起来攻击性不强,更容易让歹徒消除对立情绪,有利于下一步沟通。这些都能为谈判工作创造有利条件,从而兵不血刃地结束战斗。
大智若愚,大巧若拙,说到底,谈判其实就是沟通的艺术。如果你想不战而屈人之兵,那么首先要学会降低姿态,低调,再低调。
(摘自《意林》2008年第18期)
思想开花
在当今美女、帅哥风靡全球的时代,提出“要丑的不要帅的”的选人标准,这简直有点像“天方夜谭”,难道是武大郎开店?作者选题巧设悬念,先声夺人,引起了读者强烈的好奇心。
作品向我们揭开了“谈判专家”的神秘面纱。读完全文,你会发现,人们心目中的英雄并非如影视作品中那般高大威猛、英气逼人;要想成为一名合格的谈判专家并非易事。大智若愚,降低姿态,低调、再低调,这就是取得谈判成功的奥秘所在。其实,这也是营造和谐人际关系的法宝啊!
且读且思
3.在国内,人们是否都有资格成为“鸟人”?为什么?
2.与在动物园里观鸟相比,“鸟人”在大自然中观鸟有哪些不同?
1.“观鸟”这种新兴的户外休闲活动,为何会在各大城市渐渐流行?
|
|
起始状态物质的量n/mol |
平衡时HI的物质的量n/mol |
||
|
H2 |
I2 |
HI |
||
|
1 |
2 |
0 |
a |
|
|
① |
2 |
4 |
0 |
|
|
② |
|
|
1 |
0.5a |
|
③ |
m |
g(g≥2m) |
|
|
[分析与解答]
∵题干n(H2)起始:n(I2)起始:n(HI)平衡=1:2:a<==>2:4:2a
∴n(HI)平衡=2a
根据反应:2HI  H2+I2(气),起始状态1mol HI<==>0.5molH2+0.5molI2
根据题干n(H2)起始:n(I2)起始:n(HI)平衡=1:2:a
则 n(H2)起始:n(I2)起始:n(HI)平衡=0.5:1:0.5a
则H2和I2原有物质的量应为0和1-0.5=0.5mol
设起始HI为x mol
∵x mol
HI<==>0.5x molH2+0.5x molI2
∴n(H2)起始=(m+0.5x) mol
n(I2)起始=(g+0.5x) mol
又∵n(H2)起始:n(I2)起始=(m+0.5x):
(g+0.5x)=1:2
∴x=2(g-2m)
设n(HI)平衡为ymol,
则n(I2)起始: n(HI)平衡=2:a= (g+0.5x):y
∴y=(g-m)a
[正确答案]
H2+I2(气),起始状态1mol HI<==>0.5molH2+0.5molI2
根据题干n(H2)起始:n(I2)起始:n(HI)平衡=1:2:a
则 n(H2)起始:n(I2)起始:n(HI)平衡=0.5:1:0.5a
则H2和I2原有物质的量应为0和1-0.5=0.5mol
设起始HI为x mol
∵x mol
HI<==>0.5x molH2+0.5x molI2
∴n(H2)起始=(m+0.5x) mol
n(I2)起始=(g+0.5x) mol
又∵n(H2)起始:n(I2)起始=(m+0.5x):
(g+0.5x)=1:2
∴x=2(g-2m)
设n(HI)平衡为ymol,
则n(I2)起始: n(HI)平衡=2:a= (g+0.5x):y
∴y=(g-m)a
[正确答案]
|
|
起始状态物质的量n/mol |
平衡时HI的物质的量n/mol |
||
|
H2 |
I2 |
HI |
||
|
1 |
2 |
0 |
a |
|
|
① |
2 |
4 |
0 |
2a |
|
② |
0 |
0.5 |
1 |
0.5a |
|
③ |
m |
g(g≥2m) |
2(g-2m) |
(g-m)a |
3)恒温恒压下的等效平衡
只要按化学计量数换算成同一边的物质的量与原投料量成比例,则二者等效。
二、关于化学平衡计算
1.基本关系式(阿伏加德罗定律及推论)
同T同P: n1/n2=V1/V2
(n:气体物质的量 V:气体的体积)
同T同P: M1/M2=ρ1/ρ2 (M:气体相对分子量 ρ:气体的密度)
同T同V: P1/P2=n1/n2
(n:气体物质的量 P:气体的压强)
基本公式:m=ρV n=m/M
2.转化率(针对反应物而言)
 3.三个浓度的关系
反应物:起始浓度- 转化浓度= 平衡浓度
生成物:起始浓度+转化浓度 = 平衡浓度
4.书写格式
例3. 在2L密闭容器中,充入1 mol N2和3mol H2,一定条件下发生合成氨反应,2min时达到平衡。测得平衡混合气中NH3的体积比为25%,求:
1)υ(H2) 2) N2的转化率 3) H2在平衡时的体积分数 4) 平衡时容器的压强与起始时压强之比
解:
设N2转化的物质的量是x。
N2+3H2
3.三个浓度的关系
反应物:起始浓度- 转化浓度= 平衡浓度
生成物:起始浓度+转化浓度 = 平衡浓度
4.书写格式
例3. 在2L密闭容器中,充入1 mol N2和3mol H2,一定条件下发生合成氨反应,2min时达到平衡。测得平衡混合气中NH3的体积比为25%,求:
1)υ(H2) 2) N2的转化率 3) H2在平衡时的体积分数 4) 平衡时容器的压强与起始时压强之比
解:
设N2转化的物质的量是x。
N2+3H2  2NH3
起 1 3 0
转 x 3x 2x
平 1-x 3-3x 2x
∵NH3%=[2x/(1-x+3-3x+2x)]×100%=25%
∴2x/(4-2x)=1/4
∴x=0.4mol
υ(H2)=3×0.4mol/(L×2min)=0.3mol/(L·min)
N2的转化率=(x/1mol)×100%=40%
H2%=[(3-3x)/(4-2x)] ×100%=56.25%
P/P0=n/n0=(4-2x)/4=4:5
例4.将固体NH4I置于密闭容器中,某温度下发生下列反应:
NH4I(s) = NH3(g)+HI(g) 2HI(g)
2NH3
起 1 3 0
转 x 3x 2x
平 1-x 3-3x 2x
∵NH3%=[2x/(1-x+3-3x+2x)]×100%=25%
∴2x/(4-2x)=1/4
∴x=0.4mol
υ(H2)=3×0.4mol/(L×2min)=0.3mol/(L·min)
N2的转化率=(x/1mol)×100%=40%
H2%=[(3-3x)/(4-2x)] ×100%=56.25%
P/P0=n/n0=(4-2x)/4=4:5
例4.将固体NH4I置于密闭容器中,某温度下发生下列反应:
NH4I(s) = NH3(g)+HI(g) 2HI(g)  H2(g)+I2(g)。平衡时[H2]=0.5mol/L,[HI]=4mol/L则[NH3]为( )
A. 3.5mol/L B. 4mol/L C. 4.5mol/L D. 5mol/L
解:
NH4I(s) = NH3(g)+HI(g) 2HI(g)
H2(g)+I2(g)。平衡时[H2]=0.5mol/L,[HI]=4mol/L则[NH3]为( )
A. 3.5mol/L B. 4mol/L C. 4.5mol/L D. 5mol/L
解:
NH4I(s) = NH3(g)+HI(g) 2HI(g)  H2(g)+I2(g)
起 未知 0 0 起 x 0 0
转 x x x 转 2y y y
平 - x x 平 x-2y y y
∴y=0.5mol/L x=5mol/L
∴[NH3]=x=5mol/L
三、关于等效模型问题及其解题思路
在化学平衡中经常会遇到对已达平衡的某反应继续投入一定量的反应物或生成物,再次达到平衡后求其压强、转化率、浓度等与第一次平衡时的比较。一般解题思路是在这两次反应中建立一个中间状态,此中间状态和第一次反应达到的平衡为等效平衡,和第二次反应之间有明确的移动关系和相关量的变化,可通过中间状态的移动来判断改变条件后的移动方向和相关量的变化。
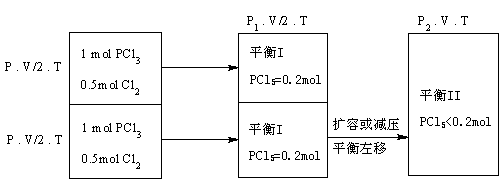
例5.一定温度下,将2mol PCl3和 1mol Cl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2
H2(g)+I2(g)
起 未知 0 0 起 x 0 0
转 x x x 转 2y y y
平 - x x 平 x-2y y y
∴y=0.5mol/L x=5mol/L
∴[NH3]=x=5mol/L
三、关于等效模型问题及其解题思路
在化学平衡中经常会遇到对已达平衡的某反应继续投入一定量的反应物或生成物,再次达到平衡后求其压强、转化率、浓度等与第一次平衡时的比较。一般解题思路是在这两次反应中建立一个中间状态,此中间状态和第一次反应达到的平衡为等效平衡,和第二次反应之间有明确的移动关系和相关量的变化,可通过中间状态的移动来判断改变条件后的移动方向和相关量的变化。
例5.一定温度下,将2mol PCl3和 1mol Cl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2  PCl5。各物质均为气态。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3 和0.5mol Cl2,相同温度下达到平衡,PCl5的物质的量为( )
A.0.4mol B.0.2mol C.0.2<x<0.4mol D.<0.2mol
[分析与解答]
对原平衡移走1mol PCl3 和0.5mol Cl2,相当于起始投料量减为原投料量的一半,若平衡不移动,PCl5的物质的量应为0.2mol。但移走反应物即减小物质的量,相当于减小浓度(减压)或增大容积,平衡向增大压强的方向进行,所以平衡左移,PCl5消耗更多,其平衡物质的量<0.2mol。
PCl5。各物质均为气态。达平衡后,PCl5为0.4mol。若此时再移走1mol PCl3 和0.5mol Cl2,相同温度下达到平衡,PCl5的物质的量为( )
A.0.4mol B.0.2mol C.0.2<x<0.4mol D.<0.2mol
[分析与解答]
对原平衡移走1mol PCl3 和0.5mol Cl2,相当于起始投料量减为原投料量的一半,若平衡不移动,PCl5的物质的量应为0.2mol。但移走反应物即减小物质的量,相当于减小浓度(减压)或增大容积,平衡向增大压强的方向进行,所以平衡左移,PCl5消耗更多,其平衡物质的量<0.2mol。
例6.体积相同的甲乙两个容器中,分别充有等物质的量的SO2、O2,使压强刚好与外界相等。在相同温度下,发生2SO2+O2
 2SO3并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变。若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率为( )
A.=P% B.>P% C.<P% D.无法确定
[分析与解答]
2SO3并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变。若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率为( )
A.=P% B.>P% C.<P% D.无法确定
[分析与解答]
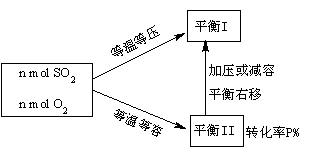
该反应是体积减小的反应,等温等压过程达到的平衡I体积比等温等容过程达到的平衡II体积要小,从平衡II到平衡I要减小体积,相当于加压,平衡右移,SO2的转化率上升,结果> P%。此处平衡II相当于中间状态。
[正确答案]B
四、关于化学平衡图象
解速率平衡图象题的六点注意:
①看坐标系,确定纵、横坐标所代表的含义。
②分析反应的特征,搞清正反应方向是吸热还是放热;体积增大还是减小、不变;有无固体或纯液体物质参加或生成等。
③分清楚自变量和因变量,弄明白始态、终态。必要时建立中间变化量以便使二者联系,并与勒沙特列原理挂钩。
④看清三点(起点、拐点、终点),分清极值、最值,比较斜率,把握曲线的变化趋势。
⑤定一议二。当图像中有三个量时,先确定一个量不变再讨论另外两个量的关系。
⑥检验结论是否正确。
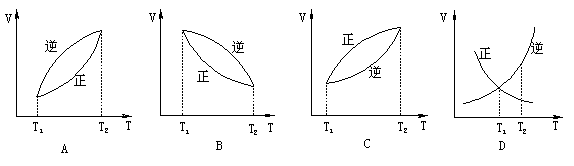
例7.A(g)+B(g)  C(g)+Q平衡后,若使温度由T1升到T2,(其他不变),则υ正与υ逆的变化曲线是( )
C(g)+Q平衡后,若使温度由T1升到T2,(其他不变),则υ正与υ逆的变化曲线是( )
 [分析与解答]
本题为改变条件对速率的影响,升温,正、逆反应速率都增大,对A(g)+B(g)
[分析与解答]
本题为改变条件对速率的影响,升温,正、逆反应速率都增大,对A(g)+B(g)  C(g)+Q,逆反应速率增大的更快。所以A正确。
例8.对于可逆反应A(g)+B(g)
C(g)+Q,逆反应速率增大的更快。所以A正确。
例8.对于可逆反应A(g)+B(g)  C(g)+Q,下列各图中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )
C(g)+Q,下列各图中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )
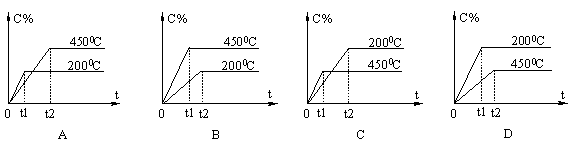 [分析与解答]
温度高速率快,所以斜率大的直线应代表高温条件,排除AD。反应A(g)+B(g)==C(g)+Q正向为放热反应,升温反应逆向移动,C%降低,所以C正确。
[参考练习]
1. 在恒温恒容的密闭容器中,充入物质的量之比为1:4的N2和H2。一定时间后达到平衡时N2和H2的物质的量之比恰好为1:5。计算:
1)平衡时混合气体中NH3的体积分数。
2)NH3的产率。
3)平衡时气体的压强与起始压强之比。
2.取1
mol A 和a mol B发生A+aB
[分析与解答]
温度高速率快,所以斜率大的直线应代表高温条件,排除AD。反应A(g)+B(g)==C(g)+Q正向为放热反应,升温反应逆向移动,C%降低,所以C正确。
[参考练习]
1. 在恒温恒容的密闭容器中,充入物质的量之比为1:4的N2和H2。一定时间后达到平衡时N2和H2的物质的量之比恰好为1:5。计算:
1)平衡时混合气体中NH3的体积分数。
2)NH3的产率。
3)平衡时气体的压强与起始压强之比。
2.取1
mol A 和a mol B发生A+aB  bC反应(A、B、C均为气态物质),当A的转化率为50%时,同温同压下测得混合气体的密度是原来的4/3,则a、b的数值可能是( )
A.a=1、b=4 B.a=3、b=3 C.a=2、b=3 D.a=3、b=2
3.一定混合气体在密闭容器中发生下列反应mA(g)+nB(g)
bC反应(A、B、C均为气态物质),当A的转化率为50%时,同温同压下测得混合气体的密度是原来的4/3,则a、b的数值可能是( )
A.a=1、b=4 B.a=3、b=3 C.a=2、b=3 D.a=3、b=2
3.一定混合气体在密闭容器中发生下列反应mA(g)+nB(g)
 pC(g)。平衡后
,在一定温度下,将气体体积缩小到原来的1/2,当达到新平衡后,C的浓度为原来的1.9倍。若压缩过程中温度保持不变,则下列说法正确的是( )
①m+n>p ②A的转化率下降 ③平衡逆向移动 ④C的体积分数增加
A.① B.①④ C. ②③ D.
④
4.一定温度下,在固定容积的密闭容器中发生可逆反应A(g)+3B(g)
pC(g)。平衡后
,在一定温度下,将气体体积缩小到原来的1/2,当达到新平衡后,C的浓度为原来的1.9倍。若压缩过程中温度保持不变,则下列说法正确的是( )
①m+n>p ②A的转化率下降 ③平衡逆向移动 ④C的体积分数增加
A.① B.①④ C. ②③ D.
④
4.一定温度下,在固定容积的密闭容器中发生可逆反应A(g)+3B(g)  2C(g),测得平衡时n(A):n(B):n(C)=3:3:1。保持温度不变,以3:3:1的体积再充入A、B、C,下列变化正确的是( )
A.充入时体系压强先增大后逐渐减小
B. 达到新平衡后混合物密度不变
C. 达到新平衡后C的体积分数减小
D. 刚充入时υ正增大,υ逆减小
E. 达到新平衡后n(A):n(B):n(C)=3:3:1
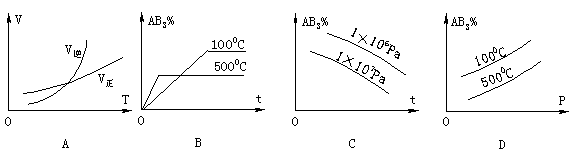
5.对于可逆反应AB3(g)
2C(g),测得平衡时n(A):n(B):n(C)=3:3:1。保持温度不变,以3:3:1的体积再充入A、B、C,下列变化正确的是( )
A.充入时体系压强先增大后逐渐减小
B. 达到新平衡后混合物密度不变
C. 达到新平衡后C的体积分数减小
D. 刚充入时υ正增大,υ逆减小
E. 达到新平衡后n(A):n(B):n(C)=3:3:1
5.对于可逆反应AB3(g)  A(g)
+3B(g)-Q,下列图象正确的是(图中AB3%为百分含量,V为反应速率,T为温度,t为时间)( )
A(g)
+3B(g)-Q,下列图象正确的是(图中AB3%为百分含量,V为反应速率,T为温度,t为时间)( )
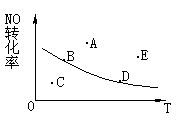
 6.2NO+O2
6.2NO+O2  2NO2+Q,NO的最大转化率与温度的关系图上标有A、B、C、D、E五点,其中表示未达到平衡状态且υ正>υ逆的是( )
2NO2+Q,NO的最大转化率与温度的关系图上标有A、B、C、D、E五点,其中表示未达到平衡状态且υ正>υ逆的是( )
7.可逆反应X(g) +Y(g)  2Z(g)+Q,若反应开始经t1秒后达到平衡,又经过t2秒后,由于反应条件的改变使平衡破坏,到t3秒又达到平衡,如图所示,试分析,从t2到t3秒曲线变化的原因是( )
A. 增大了X或Y的浓度
B. 使用了催化剂
C. 增大了反应体系的压强
D. 升高了反应的温度
2Z(g)+Q,若反应开始经t1秒后达到平衡,又经过t2秒后,由于反应条件的改变使平衡破坏,到t3秒又达到平衡,如图所示,试分析,从t2到t3秒曲线变化的原因是( )
A. 增大了X或Y的浓度
B. 使用了催化剂
C. 增大了反应体系的压强
D. 升高了反应的温度
2. 参考词汇: 图表 graph
改革开放reform and opening up
One possible version
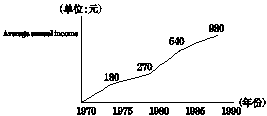
According to the figures given by the graph, the Chinese farmers' personal income rose steadily from 1970 to 1990. In the middle of 1970's their income was rather low. Their annual personal income was about 180 yuan. But in 1980 the average personal income increased to 270 yuan. As is shown by the graph, in 1985 their income doubled up to 540 yuan. After that their income are growing sharply. In a word, during the period of 20 years the farmers' income had gone up rapidly.
There were many reasons for it. Mainly the Chinese government had been carrying out a reform and opening policy, which resulted in the steady growth of farmers' income.
I believe that with a series of agricultural policies being carried out, there is no doubt that the farmers' living standard will be improved to the fullest.
3. 谈谈你的看法。
注意:1. 词数100左右。
2. 简析上述变化的原因。
2.自1970年至1990年,中国农民个人收入稳步增长,特别是改革开放政策大大促进了农村经济发展。请你根据下面图表及汉语提示,写一篇短文,描述其变化,并简述其原因。
提示:1. 根据图表,简析近20年农民平均个人收入情况。
1.根据下面曲线图,以Car Explosion in China为题,描述我国近10年来私人拥有小汽车情况,说明人们生活的水平的变化和你的看法。短文开头已给出,不计入总词数 。词数:100左右。

One possible version
Car Explosion in China
As is vividly described in the table above, great changes in car ownership have taken place in China over past decade. The number of private cars has accordingly increased nearly 7 times from more than 2 million in 1996 to over 14 million in 2006. What's the reason?
There are two main factors for these changes. To begin with, development in economy plays a vital role in these years. The higher incomes results in Chinese people's owning private cars. What's more, in modern society, time means money, many Chinese need a car to do business on time.
In my view, however, the car explosion will constantly increase year by year, a large number of social problems such as traffic jams, among other things, are turning up nearly every city in China.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com