
26.(共12分)右图中电极a、b分别为Ag电极和Pt电极,电极c、d 都是石墨电极。通电一段时间后,在c、d有气体产生,两极上共收集到336mL(标准状态)气体。回答:
 (1)直流电源中,M为 极。(1分)
(1)直流电源中,M为 极。(1分)
(2)Pt电极上生成的物质是 ,
其质量为 __g。(1分+2分)
(3)电源输出的电子的物质的量与电极
b、c、d分别生成的物质的物质的量
之比为:2∶ ∶ ∶ 。(2分)
(4)AgNO3溶液的浓度 (填“增大”、“减小”或“不变”。下同),AgNO3溶液的pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH _。(每空1分)
(5)若H2SO4溶液中溶质的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液质量为 g。(2分)
25.(共9分,每空1分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方
程式表示): ; ;
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
 AgCl(S) Ag+(aq)+
Cl-(aq) 在25℃时,氯化银的Ksp =
1.8×10-10
AgCl(S) Ag+(aq)+
Cl-(aq) 在25℃时,氯化银的Ksp =
1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1
24.(共6分,每空2分)一定温度下,向如图所示的带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应2 SO2 (g) + O2 (g) 2 SO3(g) 。
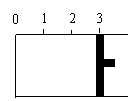 (1) 若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2 的转化率为____ ____。
(1) 若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2 的转化率为____ ____。
(2) 若开始时,充入容器的起始物质分别是
①2 L SO2 和1 L O2 ;
②2 L SO3 (g) 和 1 L N2 ;③1 L SO2 、1 L O2 和 1 L SO3 (g),使活塞固定在“3”处,达到平衡后,容器中SO3 (g)的体积分数大小关系是 (用序号和“<”、“=”、“>”表示)。
(3) 向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。
写出SO2 发生氧化反应的热化学方程式:________ 。
22(共6分,每空2分).从H+、Cu2+、Na+、SO42-、Cl-等五种离子中选择适当的离子组成电解质,使之符合下列要求。
(1)以碳棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是________________________________;
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是________________________________;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是_________________________________。
23.(共5分,每空1分)测得某溶液的pH = 6.5,且氢离子与氢氧根离子物质的量相等,此溶液呈_____性。测定温度______室温(填高于、低于或等于),其理由是 。 将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合。
(1)若所得混合液为中性,则a︰b 。
(2)若所得混合液的pH=2,则a︰b 。
21.某二元酸(H2A)按下式发生电离:H2A = H++HA-;HA-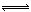 H++A2-。关于下列四种溶液的说法正确的是
( )
①0.01mol/L的H2A溶液
②0.01mol/L的NaHA溶液
③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合
④0. 02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
A.溶液①中粒子浓度大小顺序是:c(H2A)>c(H+)>c(HA-)>c(A2-)>c(OH-)
B.溶液②中有关离子浓度关系:c(HA-)+2c(A2-)+c(H2A)=c(Na+)
H++A2-。关于下列四种溶液的说法正确的是
( )
①0.01mol/L的H2A溶液
②0.01mol/L的NaHA溶液
③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合
④0. 02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
A.溶液①中粒子浓度大小顺序是:c(H2A)>c(H+)>c(HA-)>c(A2-)>c(OH-)
B.溶液②中有关离子浓度关系:c(HA-)+2c(A2-)+c(H2A)=c(Na+)
C.四种溶液中c(HA-)浓度大小:③>①>②>④ D.溶液③中有关离子浓度关系:c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+)
20.某一元酸在1mol/L的溶液中电离度为0.001%,则该溶液的导电能力接近于( )
A.1mol/L 的NaOH溶液 B.纯水 C.10-6mol/L的NaOH D.10-5mol/L的NaCl
19.用石墨电极在一定温度下电解K2SO4饱和溶液m g。当阴极产生a mol气体时,从溶液中析出n g无水晶体。则剩余溶液的溶质质量分数是 ( )
A.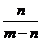 B.
B.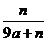 C.
C.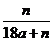 D.
D.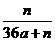
18.25℃时,pH=a的氨水与pH =b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为 ( )
A.10(a+b-12)% B.10(a+b-14)% C.10(12-a-b)% D.10(14-a-b)%
17.对达到平衡状态的可逆反应:X+Y  W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是: ( )
W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是: ( )
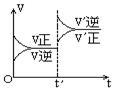 A.X、Y、W为气体,Z不是气体
A.X、Y、W为气体,Z不是气体
B.X、Y为气体,W、Z中有一种是气体
C.W、Z为气体,X、Y中有一种是气体
|
16.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( ) A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应 C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com