
23.The doctor assured the patient that there was ______ with her, but she could not help
worrying.
A.seriously wrong nothing B.nothing serious wrong
C.nothing seriously wrong D.serious nothing wrong
22.--What will the year 2012 be like?
--Hard to say,but it might be like _______ day we have spent.
A.every B.each C.any D.none
第一节 单项填空 (共15小题;每小题1分,满分15分)从A、B、C、D 四个选项中,选出可以填入空白处的最佳选项,并在答题卡上将该项涂黑。
21.The CPI went up sharply,as was reported in the newspaper,mainly due to ____ 20%
rise in ______ food prices.
A./;/ B.a; the C./;the D.a;/
(三)提出并解决问题
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: 。
30.(16分)烯烃通过臭氧氧化并经锌和水处理得到醛或酮。例如:

上述反应可用来推断烯烃的结构。一种链状单烯烃A通过臭氧氧化并经锌和水处理得到B和C。化合物B不能发生银镜反应,催化加氢生成D。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E,并且E在一定条件下能生成一种高分子化合物H。反应图示如下:

回答下列问题:
(1)8.6 g B在氧气中充分燃烧可以产生22 g CO2和9 g H2O,则B的分子式是
(2)A和D的名称(系统命名)分别为 、
(3)H的结构简式是
(4)C→F的反应类型是 E→H的反应类型是
(5)G与足量NaOH溶液反应的化学方程式是 。
(6)某种有机物的分子式与G的分子式相比仅少8个氢原子,写出满足下列条件的该有机物的所有结构简式: ①苯环上的一氯代物只有两种;②能发生银镜反应。
31. Ⅰ(6分)红外线CO2分析仪可用于测定混合气体中CO2的浓度及其变化量。将水稻的成熟绿叶组织放在密封透明的小室内给以适宜光照,在不同CO2浓度下测定光合作用速率。下图为光合作用增长率随CO2浓度变化的情况。请分析回答:
Ⅰ(6分)红外线CO2分析仪可用于测定混合气体中CO2的浓度及其变化量。将水稻的成熟绿叶组织放在密封透明的小室内给以适宜光照,在不同CO2浓度下测定光合作用速率。下图为光合作用增长率随CO2浓度变化的情况。请分析回答:
(1)光合作用速率与CO2浓度密切相关,CO2浓度直
接影响光合作用过程中 化合物的浓度。
(2)图中光合作用增长率最大的是 段,在
点光合作用速率最
大。在E点时 是光合作用速率的重要限制因子。
(3)在大田生产上地表CO2浓度对植物的光合作用有重要影响。请写出一种能提高地
表CO2浓度的方法并简析原因。方法 ,原因 。
Ⅱ.(6分)放射性同位素标记法是生物学研究的重要技术手段之一。
请回答下列问题:
(1)给小白鼠吸入18O2,一段时间后,可以检测到线粒体中有 (物质)生成。
(2)用15N标记的氨基酸培养胰腺细胞,细胞最后分泌出含有15N的胰岛素,放射性
15N在胰腺细胞中依次出现在细胞膜→ (填细胞器)→细胞膜。
(3)牛奶中含有丰富的蛋白质,有研究发现空腹喝牛奶,不能充分利用其营养价值。
请将下列实验设计补充完整,以证实上述观点。
实验步骤:
①取10只生长发育良好,月龄及体重相同的小鼠, 处理一段时间
(如12小时等),并平均分为A、B两组;
②给A组小鼠各饲喂100g葡萄糖及50g含有15N的牛奶,给B组小鼠各饲喂 ,
经过4小时后检测 。
预期实验结果: 。
32.(11分)I.图甲表示与人体内环境稳态调节有关的部分结构及关系。(“+”表示促进作用,“-”表示抑制作用)

(1)a细胞为 ,①处的激素名称为 ,作用为 (用“+”或“-”表示)。
(2)当人体进入寒冷环境中,激素C和 的分泌量将 ,导致产热量增加。
Ⅱ.下图为反射弧的模式图。X、Y为神经纤维上的实验位点,Z为突触间隙。
回答下 列问题:
列问题:
(1)从反射弧的结构组成来看,图中B为 ,
用适宜的电流刺激图中的 实验位点,均可
产生缩手反射。
(2)在神经纤维膜外安放如图所示的灵敏电流计,
若给予X点一个强刺激,X点处神经纤维膜内电位
发生的变化是 ,电流计指针发生
次偏转。
(3)某种药物可以阻断青蛙屈肌反射活动。现将药物放在X处,刺激Y点,肌肉收
缩;将药放在Z处,刺激Y点,肌肉不收缩。该实验结果证明这种药物在神经系统中的作用是阻断 。
33.(8分)下图表示一个草原生态系统的营养结构,请据图回答问题。

(1)该食物网包含了 条食物链,鹰处于第 营养级。
(2)优良牧草与杂草之间的关系主要表现为 。由于人口压力,许多草原
存在 着过度放牧的现象,这种现象首先会导致 减少,若长期如此,草原将
退化。要了解 某种优良牧草的种群密度,常用的调查方法是 。
(3)假设放养牧畜的食物90%来自牧畜喜食的牧草,且该系统能量从生产者到消费
者的传递效率为10%,从消费者到消费者的能量传递效率为20%。如果人增加的能量
为200KJ,那么其中来自牧畜喜食牧草的能量为 KJ。
(4)轻度放牧不会对草原生态系统造成破坏,原因是生态系统具有一定的 能
力。草原生态系统与森林生态系统相比较,这种能力相对较小,原因是: 。
34.(11分)下图表示几种育种方法大致过程。请分析回答:

(1)在图一所示①→②过程中发生了中发生了 。若以②的碱基序列为
模板经转录和翻译形成③,此过程与以①为模板相比一定发生变化的是 。
A.mRNA碱基序列 B.tRNA种类 C.氨基酸种类 D.蛋白质结构
(2)图二中控制高产、中产、低产(A、a)和抗病与感病(B,b)的两对等位基因
分别位于两对同源染色体上。F2的表现型有 种。F2中高产抗病植株
占 。鉴别高产抗病植株是否为纯合子的方法是 ,收获种
子种植。若子代 ,则说明植株为纯合子。在转入抗虫基因的过程
中,需要用 酶将抗虫基因与载体DNA连接,然后导入受体细胞。
(3)图二中利用F1的花粉形成个体④所应用技术的理论依据是 ,在培
养过程中,细胞必须经过 过程才能形成胚状体或丛芽。
(4)图二所示的育种方法的原理有 。
(5)图三的育种过程在现代技术中称为 。
(二)实验探究
该小组成员设计实验探究氨气还原性及产物,提供实验装置如下:

(1)请你根据提供的装置从左至右连接接口序号( )( )( )( )( )( )
(2)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是 。
(3)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式 。
(4)装置B的作用是: 。
(一)制取氨气
(1)实验室制备氨气,下列方法中适宜选用的是 (填编号)
①氯化铵溶液与氢氧化钠溶液共热;②固体氢氧化钠中滴加浓氨水;③固态氯化铵
加热分解;④固态硝酸铵加热分解;⑤固态氯化铵与熟石灰混合加热。
(2)写出实验室制取氨气的化学方程式 。
22. (6分)利用单摆测定重力加速度时,所用悬线长为
(6分)利用单摆测定重力加速度时,所用悬线长为 为103.0毫米,摆球直径为4.2毫米,摆球质量为240克。完成30次全振动用时63.0秒。下列几种说法正确的是( )
为103.0毫米,摆球直径为4.2毫米,摆球质量为240克。完成30次全振动用时63.0秒。下列几种说法正确的是( )
A.完成一次实验计算出重力加速度,变更摆球的质量,重做几
次实验,求出几次实验得到的重力加速度的平均值作为最终结
果。
B.单摆从平衡位置拉开的角度不应超过
C.用停表测出单摆完成一次全振动所用的时间,重复测量后取平均值,即为单摆的
振动周期
D.在测定周期时,最好从摆球通过平衡位置时开始计时。
E.单摆作简谐振动通过平衡位置时合力为零。
F.单摆的周期为2.1秒,单摆的摆长为1.072米
23.(12分)(1)有一新型材料制成薄膜电阻R0,既能承受大电流的冲击,小电流流入又能产生明显变色反应,阻值稳定但不详,用欧姆表粗测其阻值结果如左所示(选档旋钮置于:×1K档位上)。欧姆表测得的电阻值约为 Ω;用螺旋测微器测量厚度,其厚度结果如右所示,由此可知其厚度为 mm。

(2)现有下列器材,试设计适当的电路,选择合适的器材,较精确地测定(1)中薄
膜电阻R0的阻值(滑动变阻器的调节要方便)。
1.电流表A1,量程0-400μA,内阻约150Ω
电流表A2,量程0-10mA,内阻约45Ω
2.电压表V1,量程0-3V,内阻约6KΩ
电压表V2,量程0-15V,内阻约30KΩ
3.干电池两节E1,每节电动势为1.5V
直流稳压电源E2,输出电压6V,额定电流3A
直流稳压电源E3,输出电压24V,额定电流0.5A
4.滑动变阻器R1,0-50Ω,1A
滑动变阻器R2,0-4KΩ,0.1A
5.电键S一只,导线若干
①电流表应该选择 ,电压表应该选择 ,电源应该选择 滑
动变阻器最好选择 (填字母代号);
②,在方框中画出电路原理图

24. (16分)如图所示,在高为h=3.2m的水平台面上放着两个质量分别为m2=0.2Kg和m3=0.3Kg的小球B、C,其中C用轻质弹簧与左边固定的档板连接,开始时C球静止在O点,弹簧处于自然长度。O点右侧台面光滑,左侧台面粗糙,各球与左侧台面间的动摩擦因数均为μ=0.2。现有一质量为m1=0.1Kg的小球A以V0=10m/s的速度向左运动,与B球发生正碰,A球被反弹后从水平台面上飞出,落地点距平台右边缘的水平距离为s=4m,而B球和C球在极短的时间内发生正碰,碰后粘在一起共同压缩弹簧,使弹簧具有最大弹性势能Ep=2.0J。已知三个小球均可看作质点,弹簧的形变在弹性限度内,不计空气阻力,g取10m/s2。求小球B、C碰后压缩弹簧的最大形变量x。
(16分)如图所示,在高为h=3.2m的水平台面上放着两个质量分别为m2=0.2Kg和m3=0.3Kg的小球B、C,其中C用轻质弹簧与左边固定的档板连接,开始时C球静止在O点,弹簧处于自然长度。O点右侧台面光滑,左侧台面粗糙,各球与左侧台面间的动摩擦因数均为μ=0.2。现有一质量为m1=0.1Kg的小球A以V0=10m/s的速度向左运动,与B球发生正碰,A球被反弹后从水平台面上飞出,落地点距平台右边缘的水平距离为s=4m,而B球和C球在极短的时间内发生正碰,碰后粘在一起共同压缩弹簧,使弹簧具有最大弹性势能Ep=2.0J。已知三个小球均可看作质点,弹簧的形变在弹性限度内,不计空气阻力,g取10m/s2。求小球B、C碰后压缩弹簧的最大形变量x。
25.(18分)如图所示,皮带传动装置与水平面夹角为30°,轮半径R= m,两轮轴心相距L=8.15m,A、B分别使传送带与两轮的切点,轮缘与传送带之间不打滑,一个质量为0.1kg的小物块与传送带间的动摩擦因数为μ=
m,两轮轴心相距L=8.15m,A、B分别使传送带与两轮的切点,轮缘与传送带之间不打滑,一个质量为0.1kg的小物块与传送带间的动摩擦因数为μ=  .小物块相对于传送带运动时,会在传送带上留下痕迹.当传送带沿逆时针方向匀速运动时,小物块无初速地放在A点,运动至B点飞出.若传送带沿逆时针方向匀速运动的速度v0=1.5m/s,求划痕的长度?
.小物块相对于传送带运动时,会在传送带上留下痕迹.当传送带沿逆时针方向匀速运动时,小物块无初速地放在A点,运动至B点飞出.若传送带沿逆时针方向匀速运动的速度v0=1.5m/s,求划痕的长度?

26.(20分)图中E为电源,电动势E=330V,内阻不计。电阻R1=20 ,R2=200
,R2=200 。平行板电容器板长
。平行板电容器板长 =18cm,两板间距
=18cm,两板间距 =18cm。一带负电的粒子电量
=18cm。一带负电的粒子电量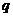 =8×
=8× C,质量
C,质量
m=8× Kg,从O1点沿两板中心线O1O2飞入两板间,初速度
Kg,从O1点沿两板中心线O1O2飞入两板间,初速度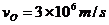 。界面AB、CD间无电场,界面CD右侧有一固定在中心线上O2点的点电荷M。粒子在界面CD右侧运动过程中动能保持不变。已知两界面AB、CD相距为S=27cm。设界面CD右侧点电荷的电场分布不受界面的影响,不计粒子的重力。已知静电力常数为
。界面AB、CD间无电场,界面CD右侧有一固定在中心线上O2点的点电荷M。粒子在界面CD右侧运动过程中动能保持不变。已知两界面AB、CD相距为S=27cm。设界面CD右侧点电荷的电场分布不受界面的影响,不计粒子的重力。已知静电力常数为 ,求:
,求:
(1)平行板电容器两极板间的电压U
(2)粒子穿过界面CD时偏离中心线O1O2的距离L
(3)点电荷的电量Q
27.(14分) 为减小和消除CO2对环境的影响,有科学家提出“绿色自由”构想。即先把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:

(1)写出分解池中反应的化学方程式 。
(2)在合成塔中,当有4.4kg CO2与足量H2完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式 。
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式 。
当电子转移为 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)在体积为l L的密闭容器中,充入1mol CO2和3molH2在500°C下发生反应。有关物质的浓度随时间变化如下图所示。

①从反应开始到平衡,H2的平均反应速率v(H2)= 。
②若其他条件不变,只将温度提高到800°C,再次达平衡时,n(CH3OH)/n(CO2)比值 (填“增大”、“减小”或“不变”)。
③从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,原因之一是考虑到催化剂的催化活性,原因之二是 。
28.(14分)A、B、C、D、E、F六种元素均是短周期元素,且原子序数依次增大。B、F原子的最外层电子数均为其电子层数的两倍,D、F元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙均能反应(相对分子质量甲< 乙)转化关系如图(反应条件略去),元素E形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:

(1)写出M与甲的浓溶液加热时反应的化学方程式 。
(2)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(3)将X、W与D2按1:1:n通入Z中,充分反应后无气体剩余或生成,则n= ,写出反应的化学方程式 。
(4)化合物ED2与元素B形成的某种单质晶体类型相同,且在高温下能发生置换反应。若反应中B的单质被破坏1mol共价键,则参加反应的化合物ED2的质量为 g。
(5)元素B的另一种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,则12g该晶体中含有 NA个正六边形。
29.(16分)某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与活动并完成下列研究:
21. 空间某一静电场的电势φ在y轴上的分布如图所示,y轴上A、B两点电场强度在
空间某一静电场的电势φ在y轴上的分布如图所示,y轴上A、B两点电场强度在 方向上的分量分别是
方向上的分量分别是 ,下列说法中正确的有( )
,下列说法中正确的有( )
A. 的大小大于
的大小大于 的大小
的大小
B. 的方向沿y轴正方向
的方向沿y轴正方向
C.O点场强在y轴方向上的分量最大
D.正电荷沿y轴从A移到B的过程中,电场力先做负功,后做正功
第Ⅱ卷(非选择题共174分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com