
29.(10分)根据下面甲、乙、丙三个图解回答有关问题:

(1)请写出两种鉴定甲细胞是否为活细胞的实验方法:
① ②
(2)已知乙细胞的分泌物是蛋白质类物质。蛋白质类分泌物除可能是酶外,还可能是
(至少写出两种可能的分泌物名称)。若该分泌物是H2O2酶,欲比较该酶与无机催化剂的催化效率,则除需要H2O2酶及必需的实验器具外,还需要哪些实验药品? 。
(3)图丙所示生物常使人及其他生物产生疾病,该类生物与细菌在结构上的主要区别是:
。
28.(11分)某研究性学习小组为探究铜、锌与浓盐酸的反应,设计实验探究方案如下:
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:
|
背影资料:
|
请你参与以下探究:
(1)实验A反应速度明显比B小,原因是 。
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是 。
②某同学作了如下猜想:是否成立?请你设计实验方案加入验证。
|
猜想 |
验证方法 |
预测现象及结论 |
|
认为铜片中可能含有锌等杂质 |
|
|
(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体。若利用资源卡片资料大胆猜想,白色沉淀可能是CuCl。请你帮他设计验证方案(若有多处方案,只设计两个)。
|
猜想 |
预计验证方法 |
猜想的现象与结论 |
|
白色沉淀是氯化亚铜 |
|
|
|
|
|
(4)指导老师肯定了实验D中的白色沉淀是CuCl;并措出生成沉淀的原因,实际上是[CuCl4]2等离子与CuCl(s)、Cl三者之间所形成的沉淀溶解平衡移动的结果。请写出这一平衡关系式(用离子方程式表示): 。
26.(14分)CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:

图中G(RCOOR,)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物。已知D由CO和H2按物质的量之比为1∶2完全反应而成,其氧化产物可发生银镜反应;H是含有4个碳原子的化合物。试写出:
(1)结构简式:E 、G 、R,基 。
(2)G的两个同类别同分异构体的结构简式(不带R字母) 及 。
(3)反应类型:X 、Y 、Z 。
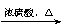
 (4)写出下列转化的化学方程式:
(4)写出下列转化的化学方程式:
① A + CO + H2O E; ②F + D H
① ;
② 。
 27.(14分)高铁酸钾(K2FeO4)是一种集氧化、吸附、
27.(14分)高铁酸钾(K2FeO4)是一种集氧化、吸附、
絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新
型、高效、绿色环保的多功能水处理剂。近十几年
来,我国对高铁酸钾在饮用水处理中的应用的研究
也不断深入,已取得可喜成果。比较理想的制备方
法是次氯酸盐氧化法:先向KOH溶液中通入足量
Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,
得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾。
(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:
①Fe3++3OH-=Fe(OH);② 。
(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物。将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4)=1.0mmol·L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO+2-4)的变化,结果见下图。高铁酸钾与水反应的离子反应方程式为 ,该反应的△H 0(填“>”“<”或“=”)。
(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压。高铁电池的总反应为:
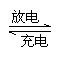
3Zn+2K2FeO4+8H2O 3Zn(OH)3+2Fe(OH)3+4KOH
该电池放电时的负极反应式为 ,若外电路有5.418×1022个电子通过,则正极有 g高铁酸钾参与反应。
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO-2与FeO2-4反应生成Fe(OH)3和CrO2-4
步骤3:加足量稀硫酸,使CrO2-4转化为Cr2O2-2,CrO-2转化为Cr3+,Fe(OH)3转化为Fe2+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1mL。
①滴定时发生反应的离子方程式为 。
②原溶液中K2FeO4的浓度为 (用含字母的代数式表示)。
25.(19分)已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有 。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为 ,E的基态电子排布式为 ,E3+与E2+的稳定性大小为 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为 ,电负性由小到大的顺序为 。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的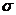 键和
键和 键的数目之比为
;F、G对应的氢化物中键能大小为F-H键
G-H键。
键的数目之比为
;F、G对应的氢化物中键能大小为F-H键
G-H键。
(4)等浓度、等体积的盐酸和氢氧化铀溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为 ,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为 。
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱 。由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液硅酸性,则该溶液中各种离子的浓度由大到小的顺序为 ,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为 。
24.(20分)如图所示,在倾角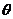 =30°的斜面上放置一段凹槽B,B与斜面间的动摩擦因数
=30°的斜面上放置一段凹槽B,B与斜面间的动摩擦因数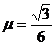 ,槽内靠近右侧壁处有一小球A,它到凹槽内左侧壁的距离
,槽内靠近右侧壁处有一小球A,它到凹槽内左侧壁的距离 .A、B的质量都为m=2.0kg.B与斜面间的最大静摩擦力可认为等于滑动摩擦力,不计A、B之间的摩擦,斜面足够长。现同刚由静止释放A、B,经过一段时间,A与B的侧壁发生碰撞, 碰撞过程不损失机械能,碰撞时间极短。取重力加速度g=10m/s。2求:
.A、B的质量都为m=2.0kg.B与斜面间的最大静摩擦力可认为等于滑动摩擦力,不计A、B之间的摩擦,斜面足够长。现同刚由静止释放A、B,经过一段时间,A与B的侧壁发生碰撞, 碰撞过程不损失机械能,碰撞时间极短。取重力加速度g=10m/s。2求:
(1)A与B的左侧壁第一次发生碰撞后瞬间A、B的速度。
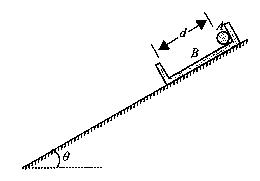 (2)在A与B的左侧壁发生第一次碰撞后到第二次碰撞前的这段时间内,A与B的左侧壁的距离最大可达到多少?
(2)在A与B的左侧壁发生第一次碰撞后到第二次碰撞前的这段时间内,A与B的左侧壁的距离最大可达到多少?
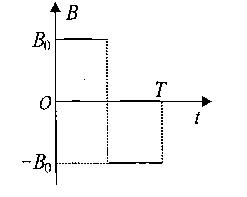
23.(16分)在坐标系 平面的第一象限内,有一个匀强磁场,磁感应强度大小恒为B0,方向垂直于
平面的第一象限内,有一个匀强磁场,磁感应强度大小恒为B0,方向垂直于 平面,且随时间作周期性变化,如同所示,规定垂直xOy平面向里的磁场方向为正。一个质量为m,电荷量为
平面,且随时间作周期性变化,如同所示,规定垂直xOy平面向里的磁场方向为正。一个质量为m,电荷量为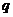 的正粒子,在
的正粒子,在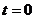 时刻从坐标原点以初速度
时刻从坐标原点以初速度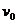 沿x轴正方向射入,不计重力的影响,经过一个磁场变化周期T(未确定)的时间,粒子到达第一象限内的某点P,日速度方向仍与x轴正方向平行同向。则
沿x轴正方向射入,不计重力的影响,经过一个磁场变化周期T(未确定)的时间,粒子到达第一象限内的某点P,日速度方向仍与x轴正方向平行同向。则
(1)粒子进人磁场后做圆周运动的半径是多大?
(2)若O、P连线与x轴之间的夹角为45°,则磁场变化的周期T为多大?
(3)若粒子运动轨迹恰好与y轴相切,试求P点的坐标。
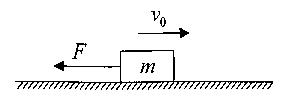
22.(14分)如图所示,质量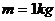 的物体,以
的物体,以 的初速度沿粗糙的水平面向右运动,物体与地面间的动摩擦因数
的初速度沿粗糙的水平面向右运动,物体与地面间的动摩擦因数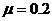 ;同时物体受到一个方向向左的3N的F的作用,经过3s,撤去外力F,求物体滑行的总位移。(g取10m/s2)
;同时物体受到一个方向向左的3N的F的作用,经过3s,撤去外力F,求物体滑行的总位移。(g取10m/s2)
21.(18分)
I(6分)某同学存做“研究平抛物体的运动”的实验时得到了如图所示的物体运动轨迹, 、
、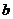 、c三点的位置在运动轨迹上已经标出,则:
、c三点的位置在运动轨迹上已经标出,则:
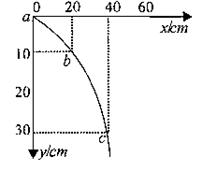
(1)小球平抛运动的初速度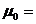 m/s(g=10 m/s2)
m/s(g=10 m/s2)
 (2)开始做平抛运动的位置坐标x= cm,y=
cm.
(2)开始做平抛运动的位置坐标x= cm,y=
cm.
Ⅱ(6分)将一单摆装置竖直悬于某一
深度为 (未知)且开几向F的固定小
(未知)且开几向F的固定小
筒中(单摆的下部分露出筒外),如图甲
所示。将悬线拉离平衡位置一个小角度
后由静止释放,没单摆摆动过程中悬线不
会碰到筒壁。如果本实验的长度测量工具
只能测量出筒下端几到摆球球心之间的距
离 ,并通过改变
,并通过改变 而测出对应的摆动周
而测出对应的摆动周
期T,再以 为纵轴、
为纵轴、 为横轴,作出
为横轴,作出
T2- 图像.则可以由此图像得出小筒的深
图像.则可以由此图像得出小筒的深
度 和当地的重力加速度g。
和当地的重力加速度g。
(1)如果实验中所得到的T2- 图像如图乙所示,那么对应的图像应该是
图像如图乙所示,那么对应的图像应该是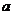 、b、c中的 。
、b、c中的 。
(2)由图像可知,小筒的深度 = m(保留两位有效数字);当地重力加速度个g=
= m(保留两位有效数字);当地重力加速度个g=
m/s2(保留三位有效数字)。
Ⅲ(6分)发光晶体二极管是电器上做指示灯用的一种电子元件。它的电路符号如图甲所示,正常使用时,带“十”号的一端接高电势,带“一”号的一端接低电势。某同学用实验的方法测得它两端的电压UD一和通过它的电流I的关系数据如下表所示。
|
UD/V |
0 |
0.2 |
0.4 |
0.6 |
0.8 |
1.0 |
1.2 |
1.4 |
1.6 |
1.8 |
2.0 |
2.2 |
2.4 |
2.6 |
2.8 |
3.0 |
|
I/mA |
0 |
0.4 |
0.9 |
1.5 |
2.3 |
3.2 |
4.3 |
5.4 |
6.8 |
9.3 |
12 |
15 |
19 |
24 |
30 |
37 |
(1)在图乙中的虚线框内画H{该同学的实验电路图。(实验用电压表内阻R v约为10 kΩ,电流表内阻RmA约为100Ω)
(2)在图丙中的小方格纸上用描点法画出,I-UD图线。
(3)若发光二极管的最佳工作电压为2.0V,而电源是由内阻不计、电动势为1.5V的两节干电池串联而成。根据画出的伏安特性曲线上的信息分析,应该将发光二极管串联一个阻值R= Ω的电阻后,与电源接成^圳合电路,才能使二极管工作在最佳状态。(保留三位有效数字)

20.如地球质量M可由表达式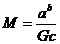 求出,式中G为引力常量,
求出,式中G为引力常量,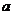 的单位是m/s,
的单位是m/s,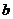 是
是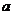 的幂次,c的单位是m/s2,以下判断正确的是 ( )
的幂次,c的单位是m/s2,以下判断正确的是 ( )
A.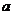 是同步卫星绕地球运动的速度,
是同步卫星绕地球运动的速度,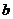 =4,c是地球表面重力加速度
=4,c是地球表面重力加速度
B.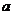 是第一宇宙速度,
是第一宇宙速度,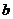 =4,c是地球表面重力加速度
=4,c是地球表面重力加速度
C.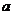 是赤道上物体的自转速度,
是赤道上物体的自转速度,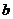 =2,c是地球表而重力加速度
=2,c是地球表而重力加速度
D.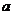 是月球绕地球运动的速度,
是月球绕地球运动的速度,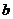 =4,c是月球表面的自由落体加速度
=4,c是月球表面的自由落体加速度
第Ⅱ卷(非选择题共180分)
19.如图,电路中,电源电动势为E、内阻为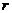 ,闭合开关S,增大可变电阻R的阻值后,电压表示数的变化量为
,闭合开关S,增大可变电阻R的阻值后,电压表示数的变化量为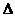 U。在这个过程中,下列判断正确的是 ( )
U。在这个过程中,下列判断正确的是 ( )
 A.电阻R1两端的电压减小,减小量等于△U
A.电阻R1两端的电压减小,减小量等于△U
B.电容器的带电量减小,减小量等于C△U
C.电压表的示数U和电流表的示数I的比值变大
D.电压表示数变化量△U和电流表示数变化量△I
的比值增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com