
28.答案:(1)CBDEAF(3分)
(2)除去空气中CO2等酸性气体及还原性气体
除去水蒸气(4分)
(3)I2+SO2+2H2O====4H++ +2I-(2分)
+2I-(2分)
(4)溶液恰好成蓝色且半分钟不褪色(2分)
(5)是。固体与气体反应,固体很难反应完全(或燃烧不充分)或溶于水的SO2部分被O2氧化。(4分)
(6)43.6%(3分)
解析:根据题意,测定黄铁矿中硫元素的质量分数,应测定硫铁矿燃烧后生成的二氧化硫的物质的量。要做到这一点,应保证以下几点:①硫铁矿燃烧完全;②生成的二氧化硫全部被水吸收;③在用碘溶液滴定含淀粉的SO2水溶液之前,一定要确保二氧化硫不变质。这样,通入的提供氧气的空气中二氧化碳等酸性气体及水蒸气一定要除净,并在吸收二氧化硫的过程中要不吸收出气管可能进入的氧气。弄清了这些问题,就不难回答以上各小题。
第(6)问:I2 SO2
SO2 S
S
1 mol 32 g
31.(22分)某化工厂的污水池中,含有一种有害的、难于降解的有机化合物A。研究人员用化合物A、磷酸盐、镁盐以及微量元素配制的培养基,成功地筛选到能高效降解化合物A的细菌(目的菌),实验的主要步骤如图所示。请分析回答问题:

(1)培养基中加入化合物A的目的是筛选____________,这种培养基属于____________培养基。
(2)“目的菌”生长所需的氮源和碳源是来自培养基中的____________,实验需要振荡培养,由此推测“目的菌”的代谢类型是____________。
(3)培养若干天后,应选择培养瓶中化合物A含量____________的培养液,接入新的培养液中连续培养,使“目的菌”的数量____________。
(4)转为固体培养时,常采用____________的方法接种,获得单菌落后继续筛选。
(5)若研究“目的菌”的生长规律,将单个菌落进行液体培养,可采用____________的方法进行计数,以时间为横坐标,以____________为纵坐标,绘制生长曲线,该生长曲线被分为四个时期,其中菌体的特点是代谢旺盛,____________和____________比较稳定,因此常作为生产用的菌种和科研材料。
(6)实验结束后,使用过的培养基应该进行____________处理后,才能倒掉。
四川省泸县九中2010届高三年级第三次模拟考试
理综答案
1答案:C 艾滋病是由于HIV攻击人体的T淋巴细胞,而导致人体丧失免疫功能。
2答案:D 子房发育成果实需要生长素,正常情况下,子房发育成果实所需的生长素来自发育着的种子,如果胚珠没有发育成种子,需要提供外源生长素,子房发育成无种子的果实。
3答案:B 本题涉及的知识范围有:构成生物体的不同组织和器官含水量是不一样的,其细胞中的自由水和结合水是可以相互转化的,比如在含水量不变的情况下,温度升高,结合水减少,自由水相对增多;衰老的细胞中自由水含量减少,代谢减弱。
4答案:C 从表中提供的数据显示:在以R(红光)最后一次照光,种子的萌发率分别为70%、74%、76%,而以FR(远红光)处理,种子萌发率只有6%。由此看出种子萌发率的高低与最后一次处理是红光还是远红光有关。
5答案:D 具有n对相对性状的两个亲本的纯合子杂交,按自由组合定律遗传,F1产生的雄配子种类为2n。F2所结种子的种皮基因型与F1相同,只有一种。F2所结果实的果皮与F1基因型相同,表现型也只有一种。F2所结种子的胚的基因型是F3的,基因型种类也不可能是2n。而F2植物体的表现型则符合2n。
6答案:A 由C6H14+19/2O2→6CO2+7H2O可知,1 mol己烷完全燃烧后,在标准状况下所生成气态产物CO2(水为液态)为6 mol,即分子数为6NA;B项中每个碳正离子CH+5所含的电子数为(6+1×5-1)个,故1 mol碳正离子所含电子总数为10NA,B项错误;C项中忽略阿伏加德罗定律使用的条件为“同温同压下”,当H2和氦气的分子数均为NA时,它们就具有相同的体积;D项中2Al+6H+====2Al3++3H2↑,2 mol铝失去6 mol电子得3 mol H2,标准状况下,置换出1 mol H2时(1 mol金属铝足量),转移电子总数为2NA。B、C、D三项均错误。
7答案:B 胰岛素是一种生物体内的蛋白质,其水解产物为α-氨基酸,检验人尿中是否含较多葡萄糖可用新制Cu(OH)2溶液,A、C、D三项正确,B项不正确。
8答案:A B项中的Fe3+、C项中的 都为有色离子,不合题意;D项中的S2-、
都为有色离子,不合题意;D项中的S2-、 在强酸性条件下不能大量存在。
在强酸性条件下不能大量存在。
9答案:C 升温、降压,C的物质的量增大,说明平衡右移,依勒夏特列原理,则正反应为吸热且气体分子数增大。
10答案:C 先判断溶液的酸碱性,然后进行比较排除。A、B两项:Na2CO3、NaHCO3溶液呈碱性,NaCl溶液呈中性,NH4Cl溶液呈酸性。Na2CO3、NaHCO3溶液相比,Na2CO3的水解能力大于NaHCO3的水解能力,则等浓度条件下,Na2CO3溶液的碱性强,pH大。观察A、B两项pH的排列,则A、B两项错误;(NH4)2SO4溶液中c( )是NH4Cl溶液中c(
)是NH4Cl溶液中c( )的两倍,则(NH4)2SO4水解产生的c(H+)大,(NH4)2SO4溶液中的pH要小,则C项正确,D项错误。或者:根据NaNO3溶液呈中性,Na2S溶液呈碱性,观察C、D两项,pH排列C项正确,D项错误。
)的两倍,则(NH4)2SO4水解产生的c(H+)大,(NH4)2SO4溶液中的pH要小,则C项正确,D项错误。或者:根据NaNO3溶液呈中性,Na2S溶液呈碱性,观察C、D两项,pH排列C项正确,D项错误。
11答案:C  不能拆成H+,A项错;NaOH吸收过量的H2S,要形成酸式盐HS-而非S2-,B项错;C项正确;D项中形成的是Fe(OH)3胶体而非Fe(OH)3沉淀,故错误。
不能拆成H+,A项错;NaOH吸收过量的H2S,要形成酸式盐HS-而非S2-,B项错;C项正确;D项中形成的是Fe(OH)3胶体而非Fe(OH)3沉淀,故错误。
12答案:A 令三者的物质的量分别为3 mol,发生的反应为:2Na2O2+2CO2====2Na2CO3+O2。现气体体积变为原来的8/9,即剩余气体的物质的量为8 mol。若二氧化碳完全与过氧化钠反应,则气体的物质的量减少数1.5 mol,即剩余气体为7.5 mol,说明二氧化碳有剩余。由计算可知,参加反应的二氧化碳的物质的量为2 mol。从而得出答案为A项。
13答案:D 此题比较的是溶液中氯离子的浓度,我们最容易把它看成是物质的量的关系。只要明确化学式和该溶液的物质的量浓度,化学式中所含氯离子的个数与溶液溶质的物质的量浓度的乘积即为溶液中氯离子的物质的量浓度。
14答案:A 理想气体封闭在绝热气缸内,当活塞压缩气体时,外界对气体做功,使理想气体的内能增加,而理想气体是没有分子势能的,所以只能是温度升高,分子的平均动能和平均速率增加,但不是所有分子的速率都增加,有些气体分子的速率是减小的,所以A项正确,B项错误;由于气体的质量不变,体积变小,所以气体的分子密度增大,C项错误;由上述分析可知分子的平均速率增大,所以单位时间内气体分子碰撞器壁单位面积的次数也增多,D项错误
15答案:B 由图可知半衰期是45亿年,90亿年75%的铀变成铅。
16答案:C 根据礼花向上是做匀减速运动,初速度为v0,末速度为零,所以由匀变速运动的平均速度公式 ,由题中礼花在4 s内运动了100 m,所以平均速度为25 m/s,所以得到礼花的初速度为50 m/s,再根据匀变速运动的速度公式:v=at,得到加速度的大小为12.5 m/s2,对礼花进行受力分析得:受到竖直向下的重力mg和竖直向下的阻力f=kv,由牛顿第二定律得:F=mg+kv=ma,解得k=0.25,则选项A、B、D错误,选项C正确。
,由题中礼花在4 s内运动了100 m,所以平均速度为25 m/s,所以得到礼花的初速度为50 m/s,再根据匀变速运动的速度公式:v=at,得到加速度的大小为12.5 m/s2,对礼花进行受力分析得:受到竖直向下的重力mg和竖直向下的阻力f=kv,由牛顿第二定律得:F=mg+kv=ma,解得k=0.25,则选项A、B、D错误,选项C正确。
17答案:B 根据直导线切割磁感线产生的感应电动势E=BLV得:电信号均匀增大,所以火车在第一段时间内是做匀加速运动,同理得到第二段时间内的电信号也是均匀增大的,所以该火车一直是在做匀加速运动,所以本题的正确选项为B项。
18答案:C 光路图如图所示,由几何关系可知,入射光第一次到达AB面时的入射角为70°,大于玻璃的临界角45°,发生了全反射,此时没有光从玻璃射入空气;入射光第二次到达AB面时,入射角为30°,小于临界角45°,有光线射入空气。故选C项。

19答案:CD 若小球动能全部转化为重力势能,小球上升的最大高度h0有:mgh0= mv20,即h0=
mv20,即h0= ,由于小球可绕O点在竖直平面内做圆周运动,其能否做完整的圆周运动,由小球能最低点获得的水平速度v0决定:如果小球在最低点的水平速度足够大时,小球就能完成整个圆周运动(能过最高点);否则小球不能达到最高点。设小球能绕O点做完整的圆周运动,其过最高点时的速度为v,则有mg≤m
,由于小球可绕O点在竖直平面内做圆周运动,其能否做完整的圆周运动,由小球能最低点获得的水平速度v0决定:如果小球在最低点的水平速度足够大时,小球就能完成整个圆周运动(能过最高点);否则小球不能达到最高点。设小球能绕O点做完整的圆周运动,其过最高点时的速度为v,则有mg≤m ,若恰好过最高点时,绳无拉力,小球做圆周运动的向心力由重力提供,即有mg=m
,若恰好过最高点时,绳无拉力,小球做圆周运动的向心力由重力提供,即有mg=m ,小球在做圆周运动过程中,机械能守恒有:mg2L=
,小球在做圆周运动过程中,机械能守恒有:mg2L= mv20-
mv20- mv2,解以上各式得v0≥
mv2,解以上各式得v0≥ ,所以,若v0≥
,所以,若v0≥ 时,小球达到最高点的速度v≥
时,小球达到最高点的速度v≥ ,其上升的最大高度h=2L<
,其上升的最大高度h=2L< ;若v0<
;若v0< 时,小球不能达到最高点,其动能全部转化为重力势能,上升的最大高度h=h0=
时,小球不能达到最高点,其动能全部转化为重力势能,上升的最大高度h=h0= 。
。
20答案:AD 如果等离子从右边射入,则正离子受到向下的洛伦兹力,偏到下极板,同理上极板有负离子,所以CD中有从下向上的电流,与GH中的电流方向相反,所以会相斥,所以选项A正确,选项B错误;如果等离子从左方射入,情况正好相反,所以CD会与GH相吸,所以选项C错误,选项D正确。综上所述,本题的正确选项应该为A、D两项。
21答案:AC 卫星运动时,万有引力提供向心力,G m
m ,∴v=
,∴v= ,所以v1∶v2=
,所以v1∶v2= ∶1。由v=Rω,有ω1∶ω2=(
∶1。由v=Rω,有ω1∶ω2=( )∶(
)∶( )=2
)=2 ∶1。正确答案为A、C两项。
∶1。正确答案为A、C两项。
22答案:(1)484 小于 灯泡电阻随温度变化而变化,温度越高电阻越大(每空2分)
(2)①电路原理图如图所示:(3分)

②a.按原理图连好电路,电阻箱阻值置于最大值。
b.单刀双掷开关置于1位置,读出电流表读数I。
c.将单刀双掷开关置于2位置,调节电阻箱使电流表的读数仍为I。
d.读出电阻箱的阻值R,即为该灯泡电阻。(8分)
23答案:(1)对B:设其加速度为a,跑出的距离为s时速度达到最大值v。
由2as=v2
有2as1=(0.8v)2(4分)
解得s1=0.64s=16 m(2分)
(2)B接棒时跑出时间为t
s1= t(4分)
t(4分)
在t时间内,对A有sA=vt
解得sA=40 m(4分)
所以B起跑时,应在距离A为Δs=sA-s1
得Δs=s2=24 m。(2分)
24答案:(1)A球在电场力的作用下做匀加速直线运动a= ,L=
,L= at2,联立①②得t=
at2,联立①②得t= (6分)
(6分)
(2)A球与B球碰撞,动量守恒mvA=mv′A+mv′B,根据题意,总能量不损失 mv2A=
mv2A= mv′2A+
mv′2A+ mv′2B,联立④⑤得v′A=0,v′B=vA=
mv′2B,联立④⑤得v′A=0,v′B=vA= (6分)
(6分)
(3)取B球为参考系,A、B碰撞后,A球发vA向左做匀减速直线运动,经时间t后,速度减为0,同时与B球相距L,然后A球向右做匀加速直线运动,又经过时间t后,速度增为vA,与B球发生第二次碰撞,同②理可证,每次总能量无损失的碰撞均为互换速度,则以后第三、四次碰撞情况可看成与第一、二次碰撞的情况重复,以此类推可知A、B两球不断碰撞的时间间隔相等,均为T=2t=2 。(7分)
。(7分)
25答案:(1)Em= BL2ω=
BL2ω= ×1×0.22×100 V=2 V
×1×0.22×100 V=2 V
(2)设外电路电阻为R′,则R′= =1 Ω(4分),据欧姆定律得电压表示数为
=1 Ω(4分),据欧姆定律得电压表示数为
U=I·R= V≈0.48 V(4分)
V≈0.48 V(4分)
(3)转动30°时,通过AD的电流为i= A,(4分)AD边受到的安培力为F安=BIL=
A,(4分)AD边受到的安培力为F安=BIL= N(4分)
N(4分)
26答案:(1)三角锥形 ∶N  N∶
N∶
N2(g)+3H2(g)  2NH3(g);
2NH3(g);
ΔH=-92.4 kJ·mol-1
(2)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(3)贮存在棕色瓶中,置于冷暗处
(4)8NH3+3Cl2====6NH4Cl+N2 22.4(转移3 mol e--被氧化1 mol NH3)
(第一空、第二空每空1分,其余每空2分)
解析:A、B、C、D、E均含元素Y,且Y在这些物质中所呈化合价依次升高,则Y元素至少有5种化合价,则一般为Cl或N,B为单质。常温下将气体D通入水中可发生反应,则只能为NO2+H2O NO+HNO3,则A、B、C、D、E依次为NH3、N2、NO、NO2、HNO3。
NO+HNO3,则A、B、C、D、E依次为NH3、N2、NO、NO2、HNO3。
27答案:(1)[3(1-a)/(3+a)]×100%
(2)大于6(1-a) 增大
(3)不能,可通过调节温度来实现。
(4)n+ =1,m+p=3
=1,m+p=3
(每空2分)
解析:(1)平衡时A的物质的量为a mol,说明参加反应的A为(1-a) mol,利用化学方程式可计算出平衡时C的物质的量为3(1-a) mol,C在反应混合气体中的百分含量是[3(1-a)/(3+a)]×100%
(2)在同一个容器中改为加入2 mol A和6 mol B,相当于原混合体系加压使压强增至原来的2倍,平衡右移,所以C的浓度比原来的2倍还要大,即大于6(1-a),C在混合气体中的百分含量增大。
(3)若在同一个容器中改为加入2 mol A和3 mol B,不管C的物质的量为多少,平衡时C在混合气体中的百分含量与原平衡时都不可能相同。因为我们可以先将C转化为A,这样便可看出A与B的物质的量都不可能为1 mol A和3 mol B,也就是C的百分含量要发生改变。可通过调节温度来实现。
(4)可将C转化为反应物A和B,由于容器的体积不变,要使C的百分含量不变,必须保证A、B的起始量与原起始量相同。所以n+ =1,m+p=3。
=1,m+p=3。
30.(20分)下图(一)为某夫妇含有AaBb两对等位基因的一个体细胞示意图,图(二)为某细胞分裂过程中DNA含量变化曲线图,图(三)为该妇女在一次生殖过程中生出男孩甲和女孩乙的示意图,请据图完成下列问题:

(1)图(一)中不能自由组合的基因是( )
A.A和a B.A和B C.a和b D.a和B
(2)图(一)中符合基因的分离规律的基因对是( )
A.A和b B.B和b C.a和b D.A和B
(3)与图(一)所示的基因组成相同的生物分别与以下基因型的生物相交配,后代表现型比分别为:
①与基因型为AaBb的生物相交________________。
②与基因型为AaBB的生物相交________________。
③与基因型为aabb的生物相交________________。
④与基因型为aaBb的生物相交________________。
A.9∶3∶3∶1 B.3∶1
C.1∶1∶1∶1 D.3∶1∶3∶1
(4)基因A与a、B与b分离;A与B(或b)随机组合发生在图(二)中___________时期。
(5)基因A与A、a与a、B与B、b与b的分离发生在图(二)中___________时期。
(6)图(二)所示细胞分裂方式与图(三)中过程Y的细胞分裂方式相比,最本质区别是___________。
(7)如果图(三)中个体甲同时患有白化病和血友病两种遗传病,而乙以及其父母均正常,若乙长大后与一正常男性结婚,已知该地区白化病患者占人群的万分之一,则他们所生子女同时患两种病的几率为___________。
29.(18分)松油醇是一种调香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
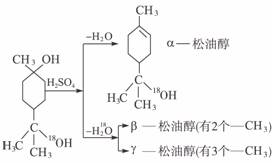
试完成下列问题:
(1)α-松油醇的分子式为_____________。
(2)α-松油醇所属的有机物类别是_____________。
a.醇 b.酚 c.饱和一元醇
(3)α-松油醇能发生的反应类型是_____________。
a.加成 b.水解 c.氧化
(4)在许多香料中松油还有少量以酯的形式出现,写出RCOOH和α-松油醇反应的化学方程式_______________________________________。
(5)写结构简式:β-松油醇_____________,γ-松油醇_____________。
28.(18分)下图是某实验室测定黄铁矿中硫元素的质量分数的装置:

实验时有如下操作:
A.将磁管中样品加热到800-850 ℃。
B.称取研细的黄铁矿样品。
C.连接好全部仪器,并检查其气密性。
D.将样品小心放入硬质磁管中部。
E.以均恒的速度不断鼓入空气。
F.用标准碘溶液滴定含淀粉的SO2水溶液。
(1)正确的实验步骤的次序是(以A、B……的序号表示)_______________。
(2)装置①的作用是_______________;装置②的作用是_______________。
(3)碘跟SO2水溶液反应的离子方程式是_____________________________________。
(4)根据______________________________现象判断滴定已达到终点。
(5)有同学认为用上述装置测出的黄铁矿中硫元素的质量分数通常将偏低,你是否同意该观点_______________(填“是”或“否”),请说出你的主要理由_______________________。
(6)假定矿样中的硫全部转化为SO2,并全部被水吸收。若称得矿样的质量为0.090 0 g,滴定管中碘溶液的初读数为1.10 mL,末读数为25.60 mL,标准碘溶液的浓度为0.050 0 mol·L-1,则该黄铁矿样品中硫元素的质量分数为_______________。
27.(12分)在一个固定容积的密闭容器中,保持一定的温度,在一定条件下进行以下反应:?A(g)+3B(g) 3C(g),已知加入1 mol A和3 mol B,平衡时A的物质的量为a mol。
3C(g),已知加入1 mol A和3 mol B,平衡时A的物质的量为a mol。
(1)达到平衡时C在反应混合气体中的百分含量是______________(用含有a的关系式表示)。
(2)在相同的实验条件下,若在同一个容器中改为加入2 mol A和6 mol B,达到平衡后,?C的物质的量为______________mol,此时C在混合气体中的百分含量______________(填“增大”“减小”或“不变”)。
(3)若在同一个容器中改为加入2 mol A和3 mol B,能否通过调节C的物质的量,使平衡时C在混合气体中的百分含量与原平衡相同?(如果能,请写出C的物质的量,如不能,请说明通过什么方法可以实现)。
(4)在相同实验条件下,如果加入n mol A、m mol B和p mol C,若要求平衡后C在混合气体中的百分含量保持不变,则n、m与p的关系是_________________________________。
26.(12分)已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,其中只有B为单质。若在常温下将气体D通入水中可以发生反应,生成C和E。工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答以下问题:
(1)A分子的空间构型为______________;B分子的电子式为______________;B发生反应生成1 mol A时放出的热量为46.2 kJ,写出该反应的热化学方程式______________________。
(2)实验室制取A的化学反应方程式为____________________________________________。
(3)E具有不稳定性,因此实验室中保存E的方法是_________________。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式___________________________;当反应中转移的电子为3 mol时,被氧化的A在标准状况下的体积为_________________L。
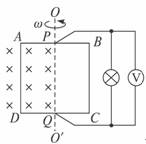
25.(20分)如图所示,将单匝正方形线框ABCD一半放入匀强磁场中,磁感应强度B=1 T,让它以边界OO′为轴,以角速度ω=100 rad/s匀速转动,在AB、CD的中点用电刷P、Q将电流输送给小灯泡,线框边长L=0.2 m,总电阻为r=4 Ω,灯泡电阻为R=2 Ω,不计P、Q接触电阻及导线电阻。求:
(1)线框转动过程中产生的最大感应电动势;
(2)理想电压表V的示数;
(3)由图示位置转过30°时,线框受到的安培力。
24.(19分)在电场强度为E的匀强电场中,有一条与电场线平行的几何线,如下图中虚线所示。几何线上有两个静止的小球A和B(均可看作质点),两小球的质量均为m,A球带电荷量+Q,B球不带电。开始时两球相距L,在电场力的作用下,A球开始沿直线运动,并与B球发生正对碰撞,碰撞中A、B两球的总动能无损失。设在各次碰撞过程中,A、B两球间无电量转移,且不考虑重力及两球间的万有引力,问:
(1)A球经过多长时间与B球发生第一次碰撞?
(2)第一次碰撞后,A、B两球的速度各为多大?
(3)试问在以后A、B两球再次不断地碰撞的时间间隔会相等吗?如果相等,请计算该时间间隔T,如果不相等,请说明理由。

23.(16分)如图所示,A、B两同学在直跑道上练习4×100 m接力,他们在奔跑时有相同的最大速度。B从静止开始全力奔跑需25 m才能达到最大速度,这一过程可看作匀变速运动,现在A持棒以最大速度向B奔来,B在接力区伺机全力奔出。若要求B接棒时奔跑达到最大速度的80%,则
(1)B在接力区需跑出的距离s1为多少?
(2)B应在离A的距离s2为多少时起跑?

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com