
9.下列比较关系中,正确的是( )
A.元素金属性Na>Mg>Al B.热稳定性H2S<H2Se<HCl
C.酸性H3PO3<H2SO4<HClO4 D.原子半径Mg>Na>H
8.下列对铯及其化合物的预测正确的是( )
A.铯的熔点很高 B.在自然界中,铯能以游离态存在
C.氯化铯易溶于水 D.铯只有一种氧化物Cs2O
7.下列说法正确的是( )
A.难失去电子的原子,易形成阴离子
B.单质分子中不存在化学键,化合物的分子才存在化学键
C.离子化合物中一定含有离子键
D.离子化合物中一定含金属键
6.与NH4+离子、质子总数和电子总数都相同的微粒是( )
A.Al3+ B.H3O+ C.OH- D.Na+
5.下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是( )
A.NaHSO4 B.NaHCO3 C.Al(OH)3 D.Na2SO3
4.根据主族元素的原子序数不能确定的是( )
A.质子数 B. 中子数 C. 价电子数 D. 相对原子质量
3.下列两核间距最小的离子化合物是( )
A.KCl B. NaF C. HF D. CaS
2.元素X、Y、Z的原子序数都小于18,X的阳离子,Y的阳离子和Z的阴离子都具有相同的电子层结构,Y的阳离子半径小于X的阳离子半径,则元素X、Y、Z的原子序数由小到大的顺序依次是( )
A.Z、Y、X B.Y、Z、X
C.Y、X、Z D.Z、X、Y
1.11g 2H218O所含的中子的物质的量为( )
A.4.5mol B.5mol C.5.5mol D.6mol
4.以典型分子结构为起点进行纵横联系
以甲烷为中心可进行如下图所示的联系:
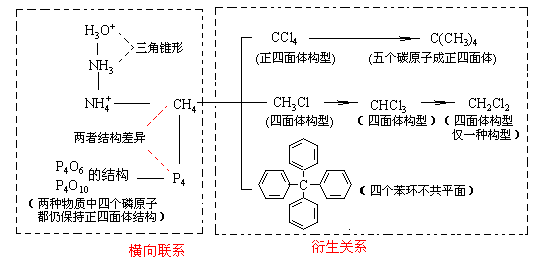
[典型题析]
[例1] 下列指定微粒的个数比为2:1的是( )
A.Be2+离子中的质子和电子
B. H原子中的中子和质子
H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
[解析] Be2+中含有4个质子、2个电子。 H原子中含有1个中子和1个质子。NaHCO3晶体中的钠离子跟碳酸氢根离子的个数比为1:1。BaO2(过氧化钡)固体中含有Ba2+、O22-阴离子和阳离子的个数比为1:1。所以答案选A。
H原子中含有1个中子和1个质子。NaHCO3晶体中的钠离子跟碳酸氢根离子的个数比为1:1。BaO2(过氧化钡)固体中含有Ba2+、O22-阴离子和阳离子的个数比为1:1。所以答案选A。
[例2]酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的是( )。
(A)R原子的电子层数比N的电子层数多1
(B)RO3-中R的化合价与NO3-中的N的化合价相等
(C)RO3-和NO3-只能被还原,不能被氧化
(D)R和N为同族元素
[解析]从“酸根RO3-所含电子数比硝酸根NO3-的电子数多10”可得出R元素的原子序数应比N大10,所以RO3-是ClO3-。进而可推出说法A、B是正确的,说明D是错误的。氯酸根离子既可以被氧化(转化为高氯酸根离子)、也可以被还原成低价态,所以说法C也是错误的。答案为AB。
[例3]1999年美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰,下列推断中不正确的是( )。
(A)原子晶体干冰有很高的熔点、沸点,有很大的硬度
(B)原子晶体干冰易气化,可用作制冷材料
(C)原子晶体干冰的硬度大,可用作耐磨材料
(D)每摩尔原子晶体干冰中含4molC-O键
[解析]解答前,应先弄清命题者是要考查干冰的性质、还是要考查原子晶体的性质。有的同学没有分析清楚这一点,认为是考查干冰的性质,因而造成错解。
通过“原子晶体干冰”来考测解题者对“原子晶体性质”的理解程度。原子晶体硬度大、熔点和沸点高,所以A和C两种说法正确。联想到二氧化硅晶体结构,可得出D说法也是正确的。答案应选B。
[例4]不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。
下面是某些短周期元素的x值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1)通过分析x值变化规律,确定N、Mg的x值范围:
_______________<x(Mg)<____________,______________<x(N)<___________________。
(2)推测x值与原子半径的关系是________________________________;根据短周期元素的x值变化特点,体现了元素性质的_________________变化规律。
(3)某有机化合物结构式为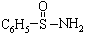 ,其中S-N中,你认为共用电子对偏向谁?_______(写原子名称)。
,其中S-N中,你认为共用电子对偏向谁?_______(写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
(5)预测元素周期表中,x值最小的元素位置:______________(放射性元素除外)。
[解析]题中给出第二、第三周期元素的x值(其中缺少了氮、镁两种元素的x值),x值与这种原子在分子中吸收电子的能力有关。
可根据元素性质的周期性变化来推测镁和氮的x值。从表中数值可看出,同周期中元素的x值随原子半径的减少而增大,x值的变化体现了元素性质的周期变化。
用x值大小可判断共价键中共用电子对偏向哪一方。对于S-N,由于N的x值大于S的x值,所以其中共用电子对偏向N原子。
表中查不到溴的x值,可根据元素周期律来推测,氯与溴同主族,氯的x值必定比溴的x值大,而:
x(Cl)-x(Al)=3.16-1.61=1.45<1.7,而溴与铝的x值这差必定小于1.45,所以溴化铝肯定属于共价化物。
x值越小,元素的金属越强,x值最小的元素应位于第六周期的IA主族。
所以答案为:(1)0.93<x(Mg)<1.61,2.55<x(N)<3.44。(2)同周期(同主族)中,x值越大,其原子半径越小;周期性。(3)氮原子。(4)共价键。(5)第六周期IA主族。
[预测与训练]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com