
24、(8分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2-3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)上述操作步骤①中错误是 (请指出
 具体错误)。由此造成的测定结果 (填偏高、偏低或无影响)。
具体错误)。由此造成的测定结果 (填偏高、偏低或无影响)。
(3)步骤②缺少的操作是
(4)某次滴定时的滴定管中的液面如图,其读数为 mL。若记录读数时,起始时俯视,终点时仰视,则所测溶液浓度会 (填偏高、偏低或无影响)。
(5)根据下列数据:
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.50 |
25.40 |
|
第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为 mol/L。
23. (7分) 如下图所示的装置,C、D、E、F都是惰性电极。
(7分) 如下图所示的装置,C、D、E、F都是惰性电极。
将电源接通后,向乙中滴入酚酞试液.在F极附近显红色。试回答以下问题:
(1)电极A的名称是 。
(2)甲装置中电解反应的总化学方程式是
。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56mL(标准状况下)气体,电解后溶液体积为500mL时,求所得溶液在25℃时的pH =__________。
(4)欲用丙装置给铜镀银,G应该是 (填“银”或“铜”), 电镀液的主要成分是(填化学式) 。
22.(6分)(1)某温度(t℃)时,水的Kw=10-13 mol2·L-2,则该温度(填大于、小于或等于) 25℃,其理由是 。
(2)将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b= ;
②若所得混合液的pH=2,则a∶b= ;
21.(7分)(1)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为:
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是
(3)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a b相连,a为负极;c d相连,c为负极;a c相连,c为正极;b d相连,b为正极,则四种金属的活动性由强到弱顺序为:
(4)写出Na2CO3溶于水后的电离方程式: ________________________________________________________
(5)写出氯化铁溶液水解反应的离子方程式: ______________________________________________
20、T℃时,A气体与B气体反应生成C气体. 反应过程中A、B、C浓度变化如图(Ⅰ)所示,并于t1时刻达到平 衡;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图(Ⅱ)所示. 则下列结论正确的是( )

A. 在(t1+10)min时,保持其它条件不变,增大压强,平衡逆向移动
B. 其它条件不变,升高温度,A的转化率一定增大
C. T℃时,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,c(C)仍为0.4mol/L
D. (t1+10) min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
19.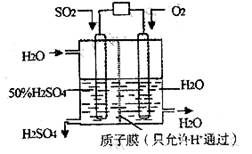 某研究小组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是( )
某研究小组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是( )
A.该装置为电解池,通入O2的电极是阳极
B.该装置中,通入SO2的电极的电极反应式为:SO2-2e-+O2-+H2O=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,若通人SO2速率为2.24 L·min-1,则通入O2速率应为1.12 L·min-1
18.25℃时,水的电离达到平衡:H2O H++OH-;ΔH>0,下列叙述正确的是( )
H++OH-;ΔH>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
17.在相同温度下,等体积、等物质的量浓度的下列溶液①Na2SO4、②H2SO3、③NaHSO3、④Na2S中,所含带电微粒数由多到少的顺序为( )
A ④>①>③>② B ①>④>③>②
C ①=④>②=③ D ④=①>③>②
16. 已知H2(g)+I2(g) ) 2HI(g)
已知H2(g)+I2(g) ) 2HI(g)  有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol ,
有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol ,
乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的
措施是( )
A.甲、乙提高相同温度 B.甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D.甲增加0.1mol H2,乙增加0.1mol I2
14.在下列溶液中,各组离子一定能够大量共存的是( )
A、使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B、由水电离的c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
C、在pH = 1溶液中:NH4+、Fe2+、NO3-、Cl-
D、所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ 15.已知:为使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量Fe3+、Fe2+,为除去这些离子制得纯净的硫酸锌,应加入的试剂是( )
A.NaOH溶液 B.氨水 C.KMnO4、ZnCO3 D.H2O2、ZnO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com