
32.(10分)
科学家利用基因工程技术对猪成纤维细胞CFTR基因进行改造,通过体细胞核移植技术和胚胎移植技术,最后获得囊性纤维病的转基因猪,为囊性纤维病的病理和治疗的研究提供了动物模型。请回答:
⑴ 对猪成纤维细胞进行基因改造过程的核心步骤是 ① 。
⑵ 培养猪成纤维细胞时,培养液中通常需加入 ② 等一些天然成分。当成纤维细胞分裂生长到细胞表面相互接触时,细胞会停止分裂增殖,这种现象称为细胞的
③ 。
⑶ 胚胎移植一般在胚胎发育至 ④ 时进行。若想同时获得遗传特性相同的多个胚胎,通常采用 ⑤ 的方法。
厦门市2010届高中毕业班适应性考试
31.[选考《有机化学基础》]
以下几种物质是常用香精的主要成分
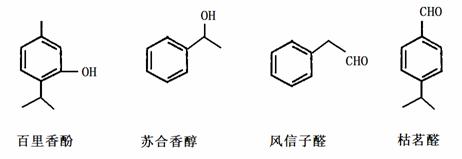
(1)鉴别百里香酚和苏合香醇采用的试剂为 ;
(2)苏合香醇能发生的有机反应类型有 ;(填序号)
A.加成反应 B.消去反应 C.加聚反应 D.缩聚反应
(3)写出符合下列条件的风信子醛的同分异构体的结构简式 ;(任写一种)
a.含有苯环,苯环上有两个支链
b.与新制氢氧化铜浑浊液共热无砖红色沉淀
(4)已知醛在一定条件下可以两分子加成:

由枯茗醛合成兔耳草醛的路线如下:

①试剂X为 ;
②写出有机物A的结构简式 ;
③写出有机物C→兔耳草醛的化学方程式 。
30.[选考《物质结构与性质》]
第四周期过渡元素常与H2O、NH3等形成配合物。
(1)写出Fe元素基态原子的核外电子排布式 ;
(2)C、N、O元素的第一电离能从大到小的顺序为 (用元素符号表示);
(3)已知铜离子可形成配位数为4的配合物,向盛有硫酸铜水溶液的试管里加入过量氨水,得到蓝色溶液,写出该反应的离子方程式 ;
(4)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子。甲和乙的主要物理性质比较如下:
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
甲 |
187 |
202 |
2.6 |
|
乙 |
272 |
423 |
以任意比互溶 |
①1 mol乙分子含有 个σ键;
②丙分子的中心原子采取 杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是
(结合具体物质解释)。
29.(12分)[物理--选修3-5](本题共有两小题,每小题6分,共12分。每小题只有一个选项符合题意。)
(1)以下关于原子核的说法正确的是
A.放射性元素的半衰期决定于原子的化学状态,与物理状态无关
B.原子序数大于或等于83的元素,都能自发地放出射线
C.β射线的穿透能力比 射线强,能穿透几厘米厚的铅板
射线强,能穿透几厘米厚的铅板
D.原子核的平均结合能越大,表示原子核中核子结合得越牢固,原子核越稳定
 (2)如图所示,A、B两质量相等的物体静止在足够长的平板小车C上,A、B之间有一根被压缩的弹簧,A、B与平板车的上表面间的滑动摩擦力之比为3:2,地面光滑,当压缩弹簧突然释放后,则
(2)如图所示,A、B两质量相等的物体静止在足够长的平板小车C上,A、B之间有一根被压缩的弹簧,A、B与平板车的上表面间的滑动摩擦力之比为3:2,地面光滑,当压缩弹簧突然释放后,则
A.最终小车静止
B.小车始终保持静止
C.初始阶段小车向右运动
D.A、B系统动量守恒
28.(12分)[物理--选修3-3](本题共有两小题,每小题6分,共12分。每小题只有一个选项符合题意。)
(1)下列说法中正确的是
A.扩散运动就是布朗运动
B.根据热力学第一定律可知热机效率不可能百分之百
C.空气相对湿度越大时,空气中水蒸气压强越接近饱和气压,水蒸发越慢。
D.由于液体表面层分子间距离小于液体内部分子间距离,液体表面存在张力
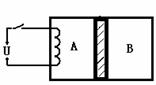 (2)如图所示,水平放置的气缸被活塞分为体积相同的A、B两部分,活塞可以无摩擦自由移动且不漏气,气缸和活塞均用绝热材料制成。A、B中分别装有等质量的同种理想气体,初始时A、B的温度相同。现接通电源,对A缓慢加热一段时间后,断开电源,活塞移动到新的位置后处于平衡状态。加热后分别用Pa、Va、Ta,Pb、Vb、Tb表示两部分气体的状态参量,Xa、Xb表示气体分子单位时间对活塞碰撞的次数,则下列说法正确的是
(2)如图所示,水平放置的气缸被活塞分为体积相同的A、B两部分,活塞可以无摩擦自由移动且不漏气,气缸和活塞均用绝热材料制成。A、B中分别装有等质量的同种理想气体,初始时A、B的温度相同。现接通电源,对A缓慢加热一段时间后,断开电源,活塞移动到新的位置后处于平衡状态。加热后分别用Pa、Va、Ta,Pb、Vb、Tb表示两部分气体的状态参量,Xa、Xb表示气体分子单位时间对活塞碰撞的次数,则下列说法正确的是
A.Pa>Pb B.Ta<Tb C.Va<Vb D.Xa<Xb
27.(16分)
 淀粉的含量、直链淀粉和支链淀粉的比例及支链淀粉的精细结构等决定着水稻的产量和稻米的品质,因此水稻淀粉合成代谢的遗传研究备受关注。相关研究的部分信息如下图所示。请回答:
淀粉的含量、直链淀粉和支链淀粉的比例及支链淀粉的精细结构等决定着水稻的产量和稻米的品质,因此水稻淀粉合成代谢的遗传研究备受关注。相关研究的部分信息如下图所示。请回答:
(1) AGPaes基因1通过 ① 来控制代谢过程,进而使水稻表现低产(淀粉含量低)性状。
(2) 用 射线处理水稻进行诱变育种。从图中可以看出,由于水稻AGPaes基因1中发生了碱基对的 ②
,因而突变为AGPaes基因2。比较研究后发现,基因突变部位编码的氨基酸分别为酪氨酸和丝氨酸。请写出基因中编码这两个氨基酸的碱基序列,并标出转录的模板链:
③ 。
射线处理水稻进行诱变育种。从图中可以看出,由于水稻AGPaes基因1中发生了碱基对的 ②
,因而突变为AGPaes基因2。比较研究后发现,基因突变部位编码的氨基酸分别为酪氨酸和丝氨酸。请写出基因中编码这两个氨基酸的碱基序列,并标出转录的模板链:
③ 。
(3) 研究表明,普通野生稻中拥有许多决定稻米优良品质的相关基因。
1) 育种工作者利用普通野生稻中存在的低比例直链淀粉突变体,以杂交育种方法培育出了优质栽培水稻品种。在杂交育种过程中,从F2代起,一般要进行多代自交和选择,自交的目的是 ④ ,选择的目的是 ⑤ 。
2) 普通野生稻含有3.75×104对基因,假定每个基因的突变率都是10-5,那么在约有107个个体的种群中,每一代出现的基因突变数是 ⑥ ,它们是进化的原材料,也将是改良栽培稻的资源。我国的普通野生稻分布于南方8个省( 区),每一个分布点的普通野生稻种群都是生物进化的 ⑦ 。
3) 据调查,在近30年间,我国的一千多个普通野生稻分布点已消失了80%,从生物多样性角度看,其直接后果是普通野生稻的 ⑧ 减少。普通野生稻的濒危现状与后果已引起政府和民众的高度警觉,为此我国已将普通野生稻定为一级农业野生保护植物。
选考部分
第Ⅱ卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卡选答区域的指定位置上。
26.Ⅰ(12分)
某研究小组观察到紫叶李的叶片呈现紫红色,并对此现象的原因进行探究。请回答:
提出问题:
紫叶李的叶片呈现紫红色的原因是什么?
作出假设
假设1:紫叶李的叶片呈现紫红色,是因为叶片中不仅含有光合色素,还含有水溶性的花青素。
假设2:紫叶李的叶片呈现紫红色,是因为叶片 ① 。
材料和试剂
紫叶李,菠菜;丙酮,石油醚,蒸馏水,碳酸钙,二氧化硅等。
实验原理
叶片中的色素能溶解在丙酮中。石油醚与水的混合液会出现分层现象。叶绿体中的色素能溶解在石油醚中,呈现绿色;花青素能溶解在水中,呈现红色。
实验步骤
第一步:提取色素
取5g紫叶李的叶片,剪碎后放入研钵中;加入 ② ,其作用是 ③ ;再加入10mL丙酮,充分研磨后收集滤液于试管中。采用同样的方法获得菠菜叶片的色素滤液,并收集于另一支试管中。
第二步:制备双相溶剂系统
取2支试管编号为A、B,各加入2mL蒸馏水,再分别加入2mL石油醚,形成双相溶剂系统。
第三步:
从第一步的两支试管中各取2mL色素滤液,分别加入试管A、B中,振荡、混匀。
第四步:
静置一段时间后,观察试管中液体的分层情况及上下两层的颜色。
实验结果
 组别 组别分层 |
紫叶李 |
菠菜 |
|
石油醚层 |
绿色 |
绿色 |
|
蒸馏水层 |
红色 |
无色 |
实验结论
④ 。
Ⅱ(12分)
下图是炎热条件下体温调节的部分过程示意图,请据图回答相关问题:

(1)图示中汗液分泌的反射途径是 ① ,其中B所在器官的名称是 ② 。
(2)当皮肤温觉感受器受到刺激产生兴奋时,膜内外两侧的电位呈 ③ 。温觉感受器产生的兴奋在反射弧中进行单向传递,是由 ④ 这一结构决定的。
(3)如图所示,分泌汗液的结果反过来又作为信息调节汗液的分泌,这种调节方式叫做
⑤ 。这是生命系统中非常普遍的调节机制,它对于机体 ⑥ 具有重要意义。
25.(15分)
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。
 请填写下列空白:
请填写下列空白:
[实验一]用如图所示装置,收集一试管甲烷和氯气的混合气体,
光照后观察到量筒内形成一段水柱,认为有氯化氢生成。
(1)该反应的反应类型为 ;
(2)该反应的化学方程式为 ;
(只写第一步)
(3)水槽中盛放的液体应为 ;(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
[实验二]收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(4)该实验设计的错误之处 ;
[实验三]
步骤一:收集半试管氯气,加入10 mL 蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH = 3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL 蒸馏水,充分振荡,测得pH = 1.00。
(5)判断该反应中有氯化氢生成的依据是 ;
(6)假设氯气完全参与反应,且不考虑氯气溶解于水。往反应后的溶液中加水稀释到100.00 mL,分别取20.00 mL稀释液,以K2CrO4为指示剂,用浓度为0.01 mol·L-1的AgNO3溶液滴定溶液中的Cl-,滴定终点时消耗AgNO3溶液的体积平均为10.00 mL,则试管中原有氯气在标准状况下的体积为 mL;
步骤三:用5支试管充满甲烷和氯气的混合气体(各占50%),分别放在40 W的日光灯下光照不同时间后,加入10 mL 蒸馏水,充分振荡,测得pH如下表:
|
编号 |
1 |
2 |
3 |
4 |
5 |
|
光照时间 |
2
min |
4
min |
6
min |
8
min |
10
min |
|
反应后pH |
1.86 |
1.62 |
1.00 |
1.00 |
1.00 |
(7)该实验可得到结论: ;
步骤四:为探究不同光照条件对甲烷与氯气反应速率的影响。
(8)试设计一个可行的实验方案: 。
24.(15分)
高温裂解法处理工业废硫酸工艺流程图如下:

废硫酸高 温裂解的基本原理可用下列方程按两个阶段进行
温裂解的基本原理可用下列方程按两个阶段进行
H2SO4(l) SO3(g)+ H2 O(g) △H= +176kJ·mol-1
2SO3(g) 2SO2(g)+ O2(g)
△H= +196k·mol-1
2SO2(g)+ O2(g)
△H= +196k·mol-1
为研究废硫酸的雾化和裂解情况,有关实验数据如下:
|
|
雾化后废硫酸液滴直径 |
废硫酸完全裂解所需时间 |
|
普通雾化器 |
800-1200
μm |
10
s以上 |
|
旋转式雾化器 |
600-850
μm |
8-10
s |
|
压缩风雾化器 |
400-650
μm |
6-7
s |
|
超声波雾化器 |
100-300
μm |
3.5-5
s |
(1)由上表数据可得出的结论是 ;
(2)废硫酸裂解成SO2总反应的热化学方程式为 ;
(3)在催化氧化室中发生反应:
2SO2(g)+ O2(g) 2SO3(g) △H=
-196 kJ·mol-1
2SO3(g) △H=
-196 kJ·mol-1
① 某温度时,该反应的平衡常数K=3.5,平衡后再充入一定量气体测得100 L的恒容密闭容器中含有3.0 mol SO2, 16.0 mol O2和3.0 mol SO3(g),此时平衡
移动;(填“向正反应方向”、“ 向逆反应方向”或“不”)
②上述反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是 ;(填字母)
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入3.0 mol N2
C.降低温度
D.在其他条件不变时,缩小容器的容积
 (4)尾气SO2用饱和Na2SO3溶液吸收可得到一种化工原料,反应的化学方程式为
;
(4)尾气SO2用饱和Na2SO3溶液吸收可得到一种化工原料,反应的化学方程式为
;
(5)科学家研究出以右图所示装置用电化
学原理生产硫酸的新工艺,其阳极的
电极反应式为 ,
总反应的化学方程式为 。
23.(15分)
 甲、乙、丙三种物质都含有A元素,只有甲是单质,其转化关系如下:
甲、乙、丙三种物质都含有A元素,只有甲是单质,其转化关系如下:
(1)若乙是目前世界倡导需减少排放的温室气体,丁也含有A元素。则含有7个中子的核素A可用符号表示为 ,丙溶液呈碱性的原因用离子方程式表示为 ;
(2)若A是非金属元素,其次外层电子是最外层电子数的2倍,则乙在现代通讯中可用于制造 ,写出一个有丙参加的、能证明碳的非金属性强于A的化学方程式 ;
(3)若甲是生活中最常用的过渡金属单质,其在点燃条件与氧气反应生成乙。若丁是稀硝酸,则乙→丙的化学方程式为 ;
(4)若A元素是第三周期元素,其最高正化合价与负价的绝对值差为4,则乙的化学式为 ,当丁是Ca(OH)2时,往丙中加入碳酸钠溶液,当碳酸钠溶液浓度大于 mol·L-1时沉淀时,丙可转化为碳酸钙。(已知此温度下,丙物质KSP=1×10-6,CaCO3的KSP= 1×10-8)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com