
3.(12分)甲:负(1分); 2H++2e-→H2↑(1分);Cl2+2OH===Cl-+ClO-+H2O(2分)
 乙:I.(1)>(1分);ClO-+H2O HClO+OH- (2分) (2)A、D(2分)
乙:I.(1)>(1分);ClO-+H2O HClO+OH- (2分) (2)A、D(2分)
III.(1)钢钉表面有红褐色物质生成(1分)
(2)ClO-+2e-+H2O→Cl-+2OH-(2分)
训练四
1、(1)羰基、羧基(2分) (2)①③(1分) (3)CH3-C≡C-CH3(2分)

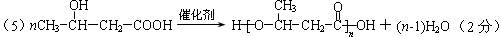 (4)OHC-CH2-O-CH2-CHO(2分)
(4)OHC-CH2-O-CH2-CHO(2分)
2
 (1)醛基(1分),①
③ ⑤(2分)
(1)醛基(1分),①
③ ⑤(2分)
(2)①C6H10O2(1分)

(3)2CH3COOH+HO(CH2)6OH CH3COO(CH2)6OOCCH3+2H2O(2分)
2. (8分)已知:
(8分)已知: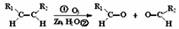 (1)该反应的生成物中含有的官能团的名称为 ,该类物质在一定条件下能发生 (填序号)。①银镜反应②酯化反应③还原反应 ④消去反应 ⑤加成反应
(1)该反应的生成物中含有的官能团的名称为 ,该类物质在一定条件下能发生 (填序号)。①银镜反应②酯化反应③还原反应 ④消去反应 ⑤加成反应
(2)已知HCHO分子中所有原子都在同一平面内,若要使R1CHO分子中所有原子都在同一平面内,R1可以为 (填序号);
(3)某氯代烃A的分子式为C6H11Cl,它可以发生如下转化:

结构分析表明E分子中含两个甲基且没有支链。试回答:①写出C的分子式 ;写出A的结构简式 。②写出由D生成E的的化学方程式
1.(12分)聚-3-羟基丁酸酯(PHB)可用于制造可降解塑料等。PHB是由许多3-羟基丁酸分子聚合而成,合成聚-3-羟基丁酸酯的途径有很多,其中一种途径的副产品少、污染小、原子利用率高,其合成路线如下:
 请回答下列问题:(1)写出C中含有的官能团的名称:______(2)上述转化过程中属于加成反应的是__ (填序号)。(3)反应②符合绿色化学思想(碳原子的有效利用率为100%),则A的结构简式为____________
请回答下列问题:(1)写出C中含有的官能团的名称:______(2)上述转化过程中属于加成反应的是__ (填序号)。(3)反应②符合绿色化学思想(碳原子的有效利用率为100%),则A的结构简式为____________
(4)写出与C互为同分异构体,能发生银镜反应,且核磁共振氢谱有两个吸收峰的有机物的结构简式:_
(5)反应④的化学方程式为_____________________________________________________。
(6)4-羟基丁酸钠(HOCH2CH2CH2COONa)是一种麻醉药。现以上述合成路线中的C物质为原料制取4-羟基丁酸钠,请写出其合成路线流程图(合成过程中无机试剂任选,并注明反应条件)。 提示:由乙醇制取聚乙烯的合成路线流程图可表示为:
3.共10分。
(1)C8H18(l)+25/2O2(g) = 8CO2(g)+9H2O(g) △H=-5121.9 kJ·mol-1(2分)
(2)增大(2分) NiOOH + H2O + e-= Ni(OH)2 + OH-(2分)
(3)① v(正)﹥v(逆)(2分) ② 1.1×10-6(2分)
训练三
2.共10分。
(1)Li2O·Al2O3·4SiO2(2分) (2)CaCO3、Mg(OH)2(2分)
(3)前者是除去Ca2+ ,浓度过大会使部分Li+沉淀;后者是沉淀Li+,浓度大有利于Li2CO3沉淀的生成(其他合理答案均可)(2分)
(4)LiH + H2O = LiOH + H2↑(2分)
(5)加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解产成Li2O,电解时产生O2(其他合理答案均可)(2分)
1.共8分。
(1)Fe3+ + 3SCN- = Fe(SCN)3(1分) 不合理(1分)。稀硝酸有强氧化性,若铁为+2价,则被氧化为+3价同样可使溶液变成血红色(1分)
(2)不合理(1分)。若铁为+3价、铁粉过量,则过量的铁可以将Fe3+还原成Fe2+(1分)
(3)+3(1分)。因n(Fe) = (5.6-1.4) /56 = 0.075 mol,n(Cl) = 32.29/143.5 = 0.225 mol,所以n(Fe) / n(Cl) = 1/3 ,则反应产物中只有+3价铁(2分)
3.(10分)近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
 (1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为_________________________________。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为_________________________________。
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:
 根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将_______(填“增大”、“不变”或“减小”),该电极的电极反应式为_________________。
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将_______(填“增大”、“不变”或“减小”),该电极的电极反应式为_________________。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度: CO(g)+1/2O2(g)  CO2(g)。
CO2(g)。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
|
容器编号 |
c(CO)/mo1·L-1 |
c (02)/mol·L-1 |
c (C02)/mol·L-1 |
v(正)和v (逆) 比较 |
|
I |
2.0×10-4 |
4.0×10-4 |
4.0×10-2 |
v(正)=v(逆) |
|
Ⅱ |
3.0×10-4 |
4.0×10-4 |
5.0×10-2 |
|
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol·L-l和1.0×10-4mol·L-l。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol·L-1,则最终尾气中C0的浓度为_________mol·L-1。
2.(10分)锂被誉为“高能金属”。工业上用硫酸与β-锂辉矿(LiAlSi2O6和少量钙镁杂质)在250-300℃反应,生成Li2SO4以及硅铝化合物、MgSO4等,其工业生产流程如下:
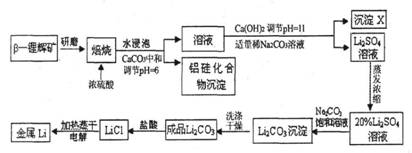
(1)用氧化物形式表示LiAlSi2O6的组成:___________________。
(2)沉淀X的主要成分是(写化学式)________________________。
(3)流程中两次使用了Na2CO3溶液,试说明前后浓度不同的原因:_________
(4)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体。试写出氢化锂遇水反应的化学方程式:______
(5)将盐酸与Li2C03完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是____________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com