
11、(1)若a=7,则HA是强酸;若a>7, 则HA是弱酸 (2) 否;c(A-)=c(Na+)
(3) 弱;c(Na+) >c(A-) > c(OH-) > c(H+) (4)10-5;10-5-10-9;10-9
10. Ⅰ(1)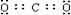 灭火 (2)8Al+3Fe3O4===9 Fe+ 4Al 2O3
灭火 (2)8Al+3Fe3O4===9 Fe+ 4Al 2O3
II(1)乙和丙(2)2Na2O2+2H2O====4NaOH+O2↑;0.6 mol
(3)OH +CO2====HCO
+CO2====HCO
9、(1)FeSO4+(NH4)2SO4+6H2O=(NH4)2Fe(SO4)2·6H2O
(2)铁与杂质形成原电池,使反应速率加快
(3)取少许所得溶液加入KSCN不变色,再加入氯水后变成红色,说明原溶液中含有Fe2+(4)①adefg ② 5、1、8、1、5、4
③由5Fe2+ + MnO4- + 8H+ = Mn2+ + 5Fe3+ + 4H2O或5Fe2+ ~ MnO4-知
100mL溶液中n(Fe2+) = 0.05mol (1分)
由(NH4)2SO4·FeSO4·6H2O ~ Fe2+ 知m(莫尔盐)=5×10-2mol×392g/mol (1分)
W(莫尔盐)=(5×10-2mol×392g/mol/23.52g)×100% = 83.33% (1分)
8、(NH4)2SO4在一定条件下发生如下反应: 4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O 若反应中转移电子为0.06mol时,将反应后的混合气体通入足量的BaCl2溶液,则产生的沉淀的质量为 ( )
A.2.33 g B.2.17 g C.4.50 g D.大于2.17 g 小于 2.33 g
 (15分)9. 莫尔是一位著名分析化学家,以他命名的莫尔盐[ (NH4)2Fe(SO4)2·6H2O]是化学分析中重要的试剂,常作为一种稳定的还原剂使用。某研究性学习小组模拟制备莫尔盐并分析得到的产品。制备实验过程如下:
(15分)9. 莫尔是一位著名分析化学家,以他命名的莫尔盐[ (NH4)2Fe(SO4)2·6H2O]是化学分析中重要的试剂,常作为一种稳定的还原剂使用。某研究性学习小组模拟制备莫尔盐并分析得到的产品。制备实验过程如下:
A中放有2g废铁屑(含铁锈,其他杂质不与稀硫酸反应),烧杯中盛有饱和硫酸铵溶液,实验时打开a,关闭b,从分液漏斗内向A中加一定量的稀硫酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水,再降温结晶获得莫尔盐晶体。
试回答:
(1)请写出在蒸发皿中制得莫尔盐的化学方程式是:
(2)滴加稀H2SO4时,发现其反应速率比同浓度硫酸与纯铁粉反应快,其原因是 。
(3)设计一个简单的实验证明产品中有Fe2+ 。
(4)为了确定产品中亚铁的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。①滴定时必须选用的仪器有 (填编号)

a b c d e f g h i j
②请配平滴定时发生反应的离子方程式配平:
Fe2++ MnO4-+ H+ - Mn2++ Fe3++ H2O
③取莫尔盐产品23.52g,配成100mL溶液,取出10mL用0.10mol/LKMnO4溶液滴定,消耗KMnO4溶液10.00mL。试求产品中莫尔盐的质量分数(要求写计算过程,(NH4)2SO4·FeSO4·6H2O的相对分子质量为392)。
(14分)10、下图表示中学化学中常见物质间转化关系。

(14分)Ⅰ、若甲、 、
、 为单质,乙、丙为氧化物;
为单质,乙、丙为氧化物;
(1)若 为非金属单质,则:乙的电子式为
。写出它的一种用途
。
为非金属单质,则:乙的电子式为
。写出它的一种用途
。
(2)若 为金属单质,则:甲+乙→丙+
为金属单质,则:甲+乙→丙+ 的化学方程式为
。
的化学方程式为
。
II、若甲、乙、丙为化合物, 、
、 为单质;
为单质;
(1)甲、乙、丙中,肯定含有 元素的是
。
元素的是
。
(2)若 为非金属单质,乙为离子化合物,甲在常温下为液态时,该反应的化学方程式可能为
;测得反应中消耗了0.6 mol乙,则转移电子的物质的量为
。
为非金属单质,乙为离子化合物,甲在常温下为液态时,该反应的化学方程式可能为
;测得反应中消耗了0.6 mol乙,则转移电子的物质的量为
。
(3)若 为金属单质时,将甲与乙反应的氧化产物(常温下为气体),通入(2)中还原产物的溶液中直至过量,该反应的离子方程式为:
。
为金属单质时,将甲与乙反应的氧化产物(常温下为气体),通入(2)中还原产物的溶液中直至过量,该反应的离子方程式为:
。
(15分)11、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
C |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1) 不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2 (选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是 。
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)= mol·L-1
c(OH-)-c(HA)= mol·L-1
(16分)12. 苯的含氧衍生物A的相对分子质量为180,其中碳元素的质量分数为60%,A完全燃烧消耗O2的物质的量与生成CO2的物质的量相等。请回答下列问题:
(1)A的分子式为__________。
(2)A的苯环上取代基彼此相间,A能发生银镜反应,也能与NaHCO3溶液反应产生CO2,还能与FeCl3溶液发生显色反应,则A含有的官能团名称是______________________,
写出A可能的一种结构简式: ________________。
(3)A的一种同分异构体B是邻位二取代苯,其中一个取代基是羧基,B能发生右图所示转化:
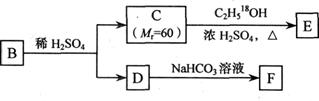
①F的结构简式是_________________________;
②写出下列反应的化学方程式:
C→E____________________________________________________________
D与浓溴水反应__________________________________________________
B与足量NaOH溶液共热________________________________________
③将等物质的量的D分别缓慢滴加到过量的氢氧化钠、碳酸钠、碳酸氢钠溶液中,完全反应后消耗的氢氧化钠、碳酸钠、碳酸氢钠的物质的物质的量之比为___________________;
④与B具有相同官能团的二取代苯且能发生银镜反应的G的可能结构共有_______种。
1 D 2 B 3 D4 A.5 C.6 D.7 D 8 C.
7、一定条件下的密闭容器中加入一定量的A发生反应:3A(?)
 2B(?)+C(?);△H>0,达平衡后,升高温度,气体平均相对分子质量有增大趋势,则下列判断正确的是( )
2B(?)+C(?);△H>0,达平衡后,升高温度,气体平均相对分子质量有增大趋势,则下列判断正确的是( )
A. A和 B 、C可能都是气体 B. B 和C可能都是气体
C. B一定是气体 D. A不可能是固体或液体
6、 A、B、C均为短周期元素,它们在周期表中的位置如下图,下列叙述不正确的是
A、B、C均为短周期元素,它们在周期表中的位置如下图,下列叙述不正确的是
A、若C非金属元素,则A单质可能形成原子晶体。
B、若B、C都是金属元素,则C的氧化物必为两性氧化物。
C、若A是金属元素,则同周期中B原子半径最大。
D.若同主族氢化物中A的氢化物沸点最高,则B一定是半导体。
5、下列离子方程式不正确的是:
A.氯化铝溶液中加入过量氨水 
B.氯化铵溶于水:


C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I- = 2Fe2++I2
D.苯酚钠溶液中通入少量二氧化碳:CO2+H2O+C6H5O-→C6H5OH+HCO3---
3、 下列实验方案合理的是 ( )
下列实验方案合理的是 ( )
A.检验酒精中的少量水:向酒精中加入足量生石灰
B.制取乙酸乙酯:用如右图所示的实验装置
C.制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条 件下反应
D.鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃观察火焰的颜色及是否有黑烟
4/阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.T ℃时,1 L pH= 6纯水中,含10-6NA个OH-
B.在标准状况下,2.24L己烷中所含分子数为6.02×1023
C.常温常压下,17g甲基(-14CH3)所含的中子数为9NA
D.电解精炼铜的过程中,每转移6.02×1023个电子时,阳极溶解铜的质量为32g
2、在给定条件下,下列加点的物质在化学反应中能被完全消耗的是 ( )
A.用50mL8 mol·L-1 浓盐酸与10g二氧化锰共热制取氯气
B.向100mL3 mol.L-1的硝酸中加入5.6g铁
C.标准状况下,将1g铝片投入20mLl8.4mol·L-1的硫酸中
D.在5×107Pa、500 ℃和铁触媒催化的条件下,用1 mol氮气和过量的氢气合成氨
1、下列各组离子在给定条件下能大量共存的是( )
A.在pH=1的溶液中:NH4+、K+、ClO-、Cl-
B、有NO-3存在的强酸性溶液中:NH+4、Ba2+、Fe2+、Br-
C、由水电离的c(H+) = 1×10-14 mol·L-1的溶液中:Ba2+、K+、Cl-、HCO3-
D、在c(H+)/ c(OH-)=1012的溶液中:NH4+ 、Al3+、Ca2+、Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com