
27、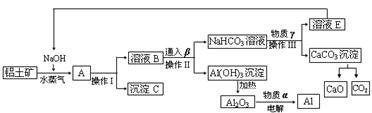 工业上用铝土矿(含氧化铝、氧化铁)制取金属铝的生产过程如下框图
工业上用铝土矿(含氧化铝、氧化铁)制取金属铝的生产过程如下框图
请回答下列问题:(1)写出铝土矿与氢氧化钠溶液反应的离子方程式
(2)沉淀C的化学式为______,该物质除了用于金属冶炼以外,还可用作 。电解熔融的氧化铝时,物质α是______,其作用是 。
 (3)在实验室中欲从溶液E中得到较纯净的固体NaOH,需要进行的操作顺序是:_______、趁热过滤、__________、
。(4)生产过程中,可以循环使用的物质有四种,除NaOH、H2O以外,另外两种物质是
(3)在实验室中欲从溶液E中得到较纯净的固体NaOH,需要进行的操作顺序是:_______、趁热过滤、__________、
。(4)生产过程中,可以循环使用的物质有四种,除NaOH、H2O以外,另外两种物质是
______、 (填化学式)。
26、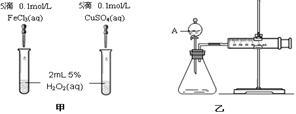 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是
________________________________
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是 _ ,实验中需要测量的数据是 。
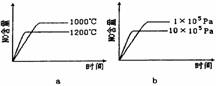
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
 ①写出H2O2在二氧化锰作用下发生反应的化学方程式
①写出H2O2在二氧化锰作用下发生反应的化学方程式
②实验时放出气体的总体积是 mL。③放出1/3气体所需时间为 min。
④反应放出3/4气体所需时间约为 min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑥解释反应速率变化的原因 。
⑦ 计算H2O2的初始物质的量浓度_____________mol/L。 (请保留两位有效数字)
25、工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g)+Q;Q =1025 kJ·mol-1
(1)该反应的平衡常数表达式为K=_____________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。

 (3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①起始时物料比c (O2):c (NH3)>1.25,其原因是_____________。②反应在第2min到第4min时O2的平均反应速率为________ mol/L·min;③反应在第2min改变了反应条件,改变的条件可能是 ________ (填序号)a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度 ④反应在第8min改变的反应条件可能是________
28、(1)A: ; C:
; C: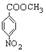 ;(每空1分,共2分)
;(每空1分,共2分)
(2)酯化(或取代)反应(1分)
(3) 3(1分)(4) 、
、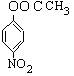 、
、 ;(每个1分共3分)
;(每个1分共3分)
(5)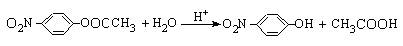 ;(1分)
;(1分)
(6)  (2分)
(2分)
训练二
27.(14分)
 (1)28 (2分)(2)2 (2分)(3)C11H12O2
(2分)
(1)28 (2分)(2)2 (2分)(3)C11H12O2
(2分)
(4)①
(2分)

②消去,(1分)
(3分)
 (3分)③
(3分)③
(2分)
26.(15分)
(1)CO2+CO +H2O==2HCO
+H2O==2HCO (3分)(2)K2CO3 (2分)(3)
(3分)(2)K2CO3 (2分)(3) (2分)(4)使原料有较大的转化率;(2分)CO2原料易得等(2分)(其它合理答案均可给分)
(2分)(4)使原料有较大的转化率;(2分)CO2原料易得等(2分)(其它合理答案均可给分)
(5)①减小 (2分) ②有利 (2分)
25.(14分)
(1)CO +H2O
+H2O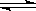 HCO
HCO +OH- (3分)
+OH- (3分)
(2)3Ba2++8OH-+2Al3++3SO ==3BaSO4↓+2AlO
==3BaSO4↓+2AlO +4H2O
(3分)
+4H2O
(3分)
(3)Ba(OH)2(ap)+2HCl(ap)==BaCl2(ap)+2H2O(l);△H= -2a kJ·mol-1 (3分)
(4)106 (2分)
(5)c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)(3分)
28、对氨基苯甲酸甲酯是一种染料中间体,用对硝基甲苯为主要起始原料经下列反应制得:
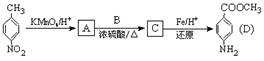
请回答下列问题:(1)写出A、C的结构简式:A , C 。
(2)A C的反应类型是 : 。
C的反应类型是 : 。
(3)用核磁共振氢谱可以证明化合物C中含有
氢处于不同的化学环境。(4)写出同时符合下列要求:①为1,4-二取代苯,其中苯环上的一个取代基是硝基;②分子中含有 结构的基团的C的所有同分异构体的结构简式:
。(5)C的同分异构体中有一种在酸性条件下水解后得到的一种产物能与FeCl3溶液发生显色反应,写出该水解反应的化学方程式
___________________
。
结构的基团的C的所有同分异构体的结构简式:
。(5)C的同分异构体中有一种在酸性条件下水解后得到的一种产物能与FeCl3溶液发生显色反应,写出该水解反应的化学方程式
___________________
。
(6)D的水解反应如下: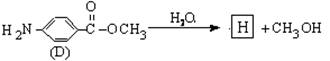
化合物H经聚合反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。
请写出该聚合反应的化学方程式 。
27.X、Y都是芳香族化合物,均为常见食用香精,广泛用于化妆品、糖果及调味品中。1 mol X水解得到1 mol Y和1 mol CH3CH2OH,X、Y的分子量都不超过200,完全燃烧都只生成CO2和H2O。且X分子中碳和氢元素总的质量百分含量约为81.8%。(1) X、Y分子量之差为____。(2)1个Y分子中应该有_____个氧原子。(3) X的分子式是____________。
 (4) G和X互为同分异构体,且具有相同的官能团,用芳香烃A合成G路线如下:① 写出A的结构简式 ② E→F的反应类型是 反应,该反应的化学方程式为: 。 ③ 写出所有符合下列条件的F的同分异构体的结构简式:
(4) G和X互为同分异构体,且具有相同的官能团,用芳香烃A合成G路线如下:① 写出A的结构简式 ② E→F的反应类型是 反应,该反应的化学方程式为: 。 ③ 写出所有符合下列条件的F的同分异构体的结构简式:
ⅰ.分子内除了苯环无其他环状结构,且苯环上有2个对位取代基。ⅱ.一定条件下,该物质既能与银氨溶液发生银镜反应又能和FeCl3溶液发生显色反应。
26.由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙醇的技术流程:
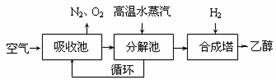 吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇。
回答下列问题:(1)写出吸收池中反应的离子方程式
。(2)从分解池中循环使用的物质是
。(3)工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为: 2CO(g)+4H2(g)
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇。
回答下列问题:(1)写出吸收池中反应的离子方程式
。(2)从分解池中循环使用的物质是
。(3)工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为: 2CO(g)+4H2(g)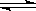 CH3CH2OH(g)+H2O(g)
请写出该反应的化学平衡常数表达式K= 。(4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数。则由CO制取CH3CH2OH的优点是 ,由CO2制取CH3CH2OH的优点是 。(写出一点即可)
CH3CH2OH(g)+H2O(g)
请写出该反应的化学平衡常数表达式K= 。(4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数。则由CO制取CH3CH2OH的优点是 ,由CO2制取CH3CH2OH的优点是 。(写出一点即可)
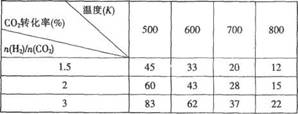 (5)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如下表:根据表中数据分析:① 温度升高,该反应的平衡常数K值 (选填“增大”、“减小”或“不变”)。 ② 提高氢碳比
(5)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如下表:根据表中数据分析:① 温度升高,该反应的平衡常数K值 (选填“增大”、“减小”或“不变”)。 ② 提高氢碳比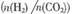 ,对生成乙醇 (选填“不利”、“有利”或“无影响”)
,对生成乙醇 (选填“不利”、“有利”或“无影响”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com