
29、 (18分)已知苯酚分子中与酚羟基直接相连的碳原子的对位上的氢原子有很好的反应活性,易与某些化合物(如  ;R,
;R, 代表烷基或H原子)发生缩合反应,生成新的有机物和水。又已知H为烃的含氧衍生物,相对分子质量不超过120,其中碳的质量分数为26.7%。G的分子式为C14H14O2,现有如下转化关系:
代表烷基或H原子)发生缩合反应,生成新的有机物和水。又已知H为烃的含氧衍生物,相对分子质量不超过120,其中碳的质量分数为26.7%。G的分子式为C14H14O2,现有如下转化关系:

(1)写出下列物质的结构简式
C ; G 。
(2)G与浓溴水反应时,1molG最多消耗 molBr2
(3)写出下列反应的方程式:
E®F ;
B®D ;
G+H 。
(4)H可与F在一定条件下反应生成六元环状化合物,该物质的结构简式为 。
28、(15分) 下图是某同学检验铜与浓硫酸反应产物并推测铜与浓硫酸反应原理的实验图。
实验步骤如下:
①连接好装置, ;
②加入相应的试剂,加热试管A直到装置B中品红溶液完全褪色;
③熄灭酒精灯;
④将铜丝上提离开液面;
⑤用洗耳球从a管口向试管A中大量鼓气,以除尽A中的SO2气体;
⑥取出铜丝,浸入稀硫酸中,铜丝表面的黑色固体溶解,溶液变为蓝色;
⑦取出试管A底部的白色固体放人盛水的烧杯中,溶液变为蓝色。

完成下列问题:
(1)完成操作步骤①: ; ,
(2)熄灭酒精灯后导管。的作用除了用于⑤中鼓空气外,还有一个重要作用是 ;
(3)C的作用是 ;C中发生反应的离子方程式为 ;
(4)由上述操作过程与现象,可推测铜与浓硫酸反应原理为 ;
(用两个化学方程式填写)。
27、(13分)设X、Y、Z、W代表4种元素。已知:①X+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9个;③Y和Z两元素可以形成四核41个电子的负一价阴离子;④W元素原子最外电子层上的电子数是其电子层数的1倍。据此填空:
(1)Y元素是 ,Z元素是 。
(2)由W、Z两元素所形成的含22个电子的化合物的电子式是 ;由X、Y、Z三元素所形成含68个电子的盐的化学式是 。
(3)W元素的单质中有一种分子W60,它可能最易发生的反应是 。
A. 消去反应 B. 取代反应 C. 加成反应 D. 聚合反应
(4)向X、Y、Z三种元素构成的化合物溶液中加入适量Z、W两种元素形成的化合物,可得一可使品红溶液褪色的物质,该反应的离子方程式为 。
26、(14分) 在一定条件下(不需添加另外的反应物),中学化学常见物质经不同的化学反应,可实现如下图的各种变化。其中,反应③④⑤属氧化还原反应,而反应①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要成份之一,其余为化合物。据此请填空:
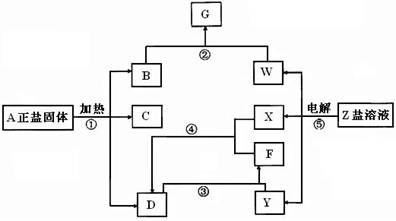
(1)物质A是 ,F是 ,Y是 。
(2)写出化合反应②的离子方程式: 。写出反应⑤的离子方程式 。
(3)写出反应④的化学方程式,并注明反应条件: 。写出反应③Y和少量D的化学方程式: 。
13、 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5反应冶炼钒,铝作还原剂
D.ETFE膜( )是由两种单体缩聚而成的
)是由两种单体缩聚而成的
第II卷(60分)
12、设NA为阿伏加德罗常数,下列说法不正确的是
A.标准状况下22.4LCl2和H2混合气体原子数为2NA
B.1molNa2O2和足量的水完全反应,转移的电子数为NA
C.300 mL2 mol·L-1蔗糖溶液中所含分子数为0.6NA
D.电解食盐水若产生2g氢气,则转移的电子数目为2NA
11、某研究小组开展课外研究发现,将适量Zn与一定浓度氯化铁溶液反应,开始可以观察到大量气泡产生。反应后期,溶液的pH升高到6左右,金属表面出现黑色粉末,溶液变成浅绿色。试管底部出现灰绿色悬浮物。收集少量黑色粉末与稀硫酸作用有气泡产生。则下列反应没有发生的是
A. FeCl3+3H2O=Fe(OH)2¯+3HCl B. Zn+2HCl=ZnCl2+H2
C. 3Zn+2FeCl3=3ZnCl2+2Fe D. 4Fe(OH)2+O2+2H2O=4 Fe(OH)3
10、 2008年北京奥运会坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现。某种兴奋剂的结构简式如右图所示,有关该物质及其溶液的说法错误的是
2008年北京奥运会坚决反对运动员服用兴奋剂,是我国支持“人文奥运”的重要体现。某种兴奋剂的结构简式如右图所示,有关该物质及其溶液的说法错误的是
A.该分子中所有氢原子不可能在同一个平面上
B.1 mol该物质与H2反应时,最多消耗7 molH2
C.加入浓溴水,既可发生取代反应,又可发生加成反应
D.滴入酸性高锰酸钾溶液,紫色褪去,可证明其结构中存在碳碳双键
9、 一定温度下,某容积恒定的密闭容器中发生如下可逆反应:CO(g)+H2(g)
一定温度下,某容积恒定的密闭容器中发生如下可逆反应:CO(g)+H2(g) C(s)+H2O(g);△H<0。以1mol
CO和2mol H2为起始反应物,t1时达到平衡,生成0.6mol H2O(g)。t2时改变反应条件,化学反应速率(v)与时间(t)的关系如右图所示。下列叙述正确的是( )
C(s)+H2O(g);△H<0。以1mol
CO和2mol H2为起始反应物,t1时达到平衡,生成0.6mol H2O(g)。t2时改变反应条件,化学反应速率(v)与时间(t)的关系如右图所示。下列叙述正确的是( )
A.起始时刻和t1达到平衡后气体的物质的量之比为4:5
B.平衡后若加入少量碳,平衡向逆反应方向移动
C.平衡后若加入氢气,上述反应的△H会增大
D.t2时改变的条件可能是增大了压强
8、下列叙述正确的是( )
①离子化合物中不一定含有金属阳离子 ②分子晶体中不一定含有共价键
③有机物中不一定都含有氢元素 ④酸酐都能直接与水反应生成相应的酸
⑤酸与碱混合都只发生中和反应 ⑥酸式盐溶于水得到的溶液都显酸性
A.只有①② B.只有①②③ C.只有③⑤⑥ D.只有①②④⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com